Wir erforschen den Boden/Wir messen die Bodenversauerung elektrometrisch: Unterschied zwischen den Versionen
Main>Cereale Keine Bearbeitungszusammenfassung |
(akt) Markierung: 2017-Quelltext-Bearbeitung |
||
| (5 dazwischenliegende Versionen von 4 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Der pH-Wert eines Bodens kann (entsprechend der angewandten Methode) verschieden aus. Daher muss die Art seiner Bestimmung stets angegeben werden. Dazu gehören: | |||
# Bestimmung frischer oder getrockneter Proben | |||
# Zusatz von Salzlösungen (Kaliumchlorid) | |||
# Verhältnis Boden : Wasser | |||
# Messverfahren und Gerätetyp | |||
# Messungen in Suspensionen, überstehender Flüssigkeit o. dgl. | |||
Hinzu kommen Angaben über den Zeitpunkt und die Tiefe der Probennahme und darüber, ob sich die Werte auf Einzel- oder Mischproben beziehen. Für pflanzenökologische Zwecke ist nur der in einer wässrigen Bodensuspension gemessene pH-Wert = pH (H20) brauchbar, da er den natürlichen Verhältnissen am besten entspricht. Von bodenkundlicher und agrikulturchemischer Seite wird dagegen die Probe in einer Salzlösung (meist n-KCl oder 0,1nKCl) aufgeschwemmt. Konventionell sind Boden und Flüssigkeit im Verhältnis 1 : 2,5 (bei humosen Böden 1 :10) zu mischen. | |||
'''Untersuchungsmaterialien''' | |||
* Als Messgerät dient ein hochohmiges Milli-Voltmeter, an dem die pH-Zahl direkt ablesbar ist, wenn die Elektrode in die Flüssigkeit gesteckt wird. | * Als Messgerät dient ein hochohmiges Milli-Voltmeter, an dem die pH-Zahl direkt ablesbar ist, wenn die Elektrode in die Flüssigkeit gesteckt wird. | ||
| Zeile 62: | Zeile 21: | ||
* Filter | * Filter | ||
*Trichter und Zubehör | * Trichter und Zubehör | ||
* Kaliumchlorid-Lösung | |||
* | * destilliertes Wasser | ||
* | * Bodenproben | ||
'''pH-Meter (elektrisch)''' | '''pH-Meter (elektrisch)''' | ||
| | [[Datei:phmeter2.jpg|600px|center]] | ||
'''Versuchsablauf''' | |||
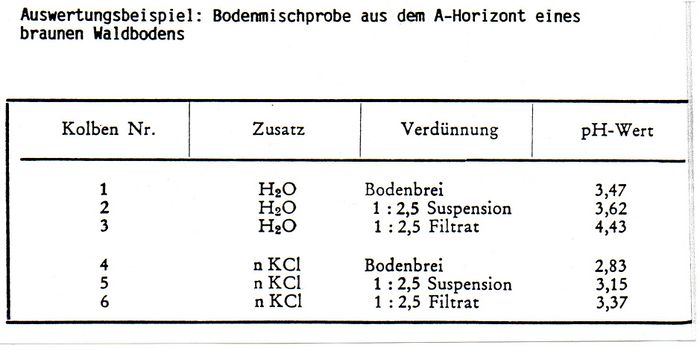
In sechs nummerierte Gefäße werden je 10 g (oder 20 g) Boden eingewogen. In die Gefäße Nr. 2 + 3 werden 25 ml destilliertes Wasser und in die Gefäße Nr. 5 + 6 je 25 ml einmolare Kaliumchloridlösung gegeben, so dass ein gut rührbarer Bodenbrei entsteht. Der Inhalt der Gefäße Nr. 2 + 3 + 5 + 6 wird gut umgerührt. Danach werden Lösungen Nr. 3 + 6 vom Bodensatz abfiltriert. Nach zehn Minuten erfolgt die pH-Messung im Bodenbrei, in der Bodenaufschwemmung und im Bodenfiltrat. Nach jeder Messung ist die Elektrode mit destilliertem Wasser bzw. Kaliumchloridlßsung gut abzuspülen. | |||
'''pH-KCl''' | |||
pH (KCl) liegt in sauren Böden tiefer, in basischen hßher als der pH (H<sub>2</sub>0). Die Ursache ist darin zu suchen, dass die mit der Salzlßsung zugefügten Kationen gegen einen Teil der Hydroxionium-Ionen aus dem Ionenschwarm der Bodenkolloide ausgetauscht werden. Die somit freigesetzten Hydroxonium-Ionen erniedrigen damit den pH-Wert. | |||
Umgekehrt werden in neutralen Böden Hydroxid-Ionen freigesetzt. Mit steigendem Flüssigkeitszusatz erhöht sich in sauren Bßden der pH-Wert (in alkalischen wird er erniedrigt). Geringer Wasserzusatz (Brei) entspricht am besten den Standortverhältnissen: Die an den suspendierten Bodenteilchen adsorbierten Hydroxonium- bzw. Hydroxid-Ionen werden dann noch mit in die Reaktion einbezogen, während im Filtrat nur die tatsachlich abgespaltenen Hydroxonlum- bzw. Hydroxid-Ionen erfasst werden. | |||
'''Hinweis zu dem Hydroxid-Ion = Anion = OH-und dem Hydroxonium-Ion''' | |||
Oxonium (auch Oxidanium) ist die Bezeichnung für [http://de.wikipedia.org/wiki/Proton_(Chemie) protoniertes] [http://de.wikipedia.org/wiki/Wasser Wasser] (H3O+) und gehört nach [http://de.wikipedia.org/wiki/IUPAC IUPAC] zu den [http://de.wikipedia.org/wiki/Wasserstoff Wasserstoffionen]. Die Bezeichnungen Hydroxonium oder Hydronium sind veraltet und sollten nach den Empfehlungen der [http://de.wikipedia.org/wiki/Nomenklatur_(Chemie) chemischen Nomenklatur] nicht mehr verwendet werden, sind aber in der Literatur noch weit verbreitet. In der Literatur versteht man unter Oxoniumion auch häufig nur ein Sauerstoffkation mit drei Bindungen. In dieser Definition ist H3O+ ein Spezialfall. Im Englischen versteht man unter "oxonium ion" ausschließlich die allgemeiner gefasste Definition. | |||
[http://de.wikipedia.org/wiki/Oxonium '''Oxonium'''] | |||
[[Bild:Tabelle3.jpg|700px|center]] | |||
[[Bild:Tabelle3.jpg|700px]] | |||
'''Erfahrungen und Konsequenzen''' | |||
Der Versuch ist als Gruppenarbeit geeignet. Für alle Messungen sind die Versuchsbedingungen möglichst einheitlich zu gestalten: | |||
* | * gleiche Messdauer der Proben | ||
* gleiche Verdünnung der Proben | * gleiche Verdünnung der Proben | ||
| Zeile 144: | Zeile 67: | ||
{{Boden}} | |||
Aktuelle Version vom 24. Februar 2019, 10:59 Uhr
Der pH-Wert eines Bodens kann (entsprechend der angewandten Methode) verschieden aus. Daher muss die Art seiner Bestimmung stets angegeben werden. Dazu gehören:
- Bestimmung frischer oder getrockneter Proben
- Zusatz von Salzlösungen (Kaliumchlorid)
- Verhältnis Boden : Wasser
- Messverfahren und Gerätetyp
- Messungen in Suspensionen, überstehender Flüssigkeit o. dgl.
Hinzu kommen Angaben über den Zeitpunkt und die Tiefe der Probennahme und darüber, ob sich die Werte auf Einzel- oder Mischproben beziehen. Für pflanzenökologische Zwecke ist nur der in einer wässrigen Bodensuspension gemessene pH-Wert = pH (H20) brauchbar, da er den natürlichen Verhältnissen am besten entspricht. Von bodenkundlicher und agrikulturchemischer Seite wird dagegen die Probe in einer Salzlösung (meist n-KCl oder 0,1nKCl) aufgeschwemmt. Konventionell sind Boden und Flüssigkeit im Verhältnis 1 : 2,5 (bei humosen Böden 1 :10) zu mischen.
Untersuchungsmaterialien
- Als Messgerät dient ein hochohmiges Milli-Voltmeter, an dem die pH-Zahl direkt ablesbar ist, wenn die Elektrode in die Flüssigkeit gesteckt wird.
- Waage
- 8 Bechergläser oder kleine Plastikbecher (für eine Probenreihe)
- Pipetten
- Filter
- Trichter und Zubehör
- Kaliumchlorid-Lösung
- destilliertes Wasser
- Bodenproben
pH-Meter (elektrisch)
Versuchsablauf
In sechs nummerierte Gefäße werden je 10 g (oder 20 g) Boden eingewogen. In die Gefäße Nr. 2 + 3 werden 25 ml destilliertes Wasser und in die Gefäße Nr. 5 + 6 je 25 ml einmolare Kaliumchloridlösung gegeben, so dass ein gut rührbarer Bodenbrei entsteht. Der Inhalt der Gefäße Nr. 2 + 3 + 5 + 6 wird gut umgerührt. Danach werden Lösungen Nr. 3 + 6 vom Bodensatz abfiltriert. Nach zehn Minuten erfolgt die pH-Messung im Bodenbrei, in der Bodenaufschwemmung und im Bodenfiltrat. Nach jeder Messung ist die Elektrode mit destilliertem Wasser bzw. Kaliumchloridlßsung gut abzuspülen.
pH-KCl
pH (KCl) liegt in sauren Böden tiefer, in basischen hßher als der pH (H20). Die Ursache ist darin zu suchen, dass die mit der Salzlßsung zugefügten Kationen gegen einen Teil der Hydroxionium-Ionen aus dem Ionenschwarm der Bodenkolloide ausgetauscht werden. Die somit freigesetzten Hydroxonium-Ionen erniedrigen damit den pH-Wert.
Umgekehrt werden in neutralen Böden Hydroxid-Ionen freigesetzt. Mit steigendem Flüssigkeitszusatz erhöht sich in sauren Bßden der pH-Wert (in alkalischen wird er erniedrigt). Geringer Wasserzusatz (Brei) entspricht am besten den Standortverhältnissen: Die an den suspendierten Bodenteilchen adsorbierten Hydroxonium- bzw. Hydroxid-Ionen werden dann noch mit in die Reaktion einbezogen, während im Filtrat nur die tatsachlich abgespaltenen Hydroxonlum- bzw. Hydroxid-Ionen erfasst werden.
Hinweis zu dem Hydroxid-Ion = Anion = OH-und dem Hydroxonium-Ion
Oxonium (auch Oxidanium) ist die Bezeichnung für protoniertes Wasser (H3O+) und gehört nach IUPAC zu den Wasserstoffionen. Die Bezeichnungen Hydroxonium oder Hydronium sind veraltet und sollten nach den Empfehlungen der chemischen Nomenklatur nicht mehr verwendet werden, sind aber in der Literatur noch weit verbreitet. In der Literatur versteht man unter Oxoniumion auch häufig nur ein Sauerstoffkation mit drei Bindungen. In dieser Definition ist H3O+ ein Spezialfall. Im Englischen versteht man unter "oxonium ion" ausschließlich die allgemeiner gefasste Definition. Oxonium
Erfahrungen und Konsequenzen
Der Versuch ist als Gruppenarbeit geeignet. Für alle Messungen sind die Versuchsbedingungen möglichst einheitlich zu gestalten:
- gleiche Messdauer der Proben
- gleiche Verdünnung der Proben
- gleiches Verrühren der Proben
Einfache Analyseverfahren
Organische Zusammensetzung
- Humusanteil
- Bakterienkunde
- Lichtmikroskop
- Plattengussverfahren
- Bakterienkeimzahl
- Bodenpilze
- Kohlenstoffdioxidbildung
- Regenwurm
Bodenwasser, -luft, -wärme
Bodenreaktion