Wir erforschen den Boden/Messung der Kohlenstoffdioxidabgabe einer Bodenprobe: Unterschied zwischen den Versionen
Main>Cereale Keine Bearbeitungszusammenfassung |
(akt) Markierung: 2017-Quelltext-Bearbeitung |
||
| (16 dazwischenliegende Versionen von 4 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
[[Datei:CladonioPinetum.jpg|500px|thumb|'''Kiefernwald''']] | |||
Kohlenstoffdioxid entsteht im Boden hauptsächlich durch die Mikroorganismenatmung (zu zwei Dritteln) und durch die Wurzelatmung (zu einem Drittel). Abiotische Kohlenstoffdioxidbildungen können in der Regel vernachlässigt werden. Das Kohlenstoffdioxid tritt an die Erdoberfläche und reichert die umgebende Luft an. In einem Kulturpflanzenbestand liegt die Kohlenstoffdioxidkonzentration in der Luft bei etwa 0,038 Volumenprozent, wobei erhebliche Schwankungen festgestellt wurden (0,025 bis 0,05 Volumenprozent), die als standortspezifisch anzusehen sind. | |||
''' | |||
{| class="wikitable" | |||
|+'''Bodenatmungswerte verschiedener Pflanzengesellschaften''' | |||
|- | |- | ||
! Standort | |||
! CO2 /m²/h | |||
|- | |- | ||
! Pflanzengesellschaft | |||
! (mg) | |||
|- | |- | ||
| unbewachsener Sandboden | | unbewachsener Sandboden | ||
| | | align="center"| 89 | ||
|- | |- | ||
| Kiefernwald | | Kiefernwald | ||
| | | align="center"| 157 | ||
|- | |- | ||
| Fichtenwald | | Fichtenwald | ||
| | | align="center"| 360 | ||
|- | |- | ||
| Buchenwald | | Buchenwald | ||
| | | align="center"| 407 | ||
|- | |- | ||
| Rübenacker | | Rübenacker | ||
| | | align="center"| 419 | ||
|- | |- | ||
| Goldhafenwiese | | Goldhafenwiese | ||
| | | align="center"| 866 | ||
|} | |||
| | |||
Mit der Bodenatmung wird dem Pflanzenbestand eine gewisse Menge Kohlenstoffdioxid zugeführt. Diese | Mit der Bodenatmung wird dem Pflanzenbestand eine gewisse Menge Kohlenstoffdioxid zugeführt. Diese dürfte aber 10 bis 20% der insgesamt von den Pflanzen verbrauchten Menge nicht überschreiten. Geht man von einem Kulturpflanzenbestand mit einer mittleren Assimilationsintensität von 0,2 mg CO<sub>2</sub>/cm<sup>2</sup>/h aus, steht dem eine Bodenatmung gegenüber, die etwa 0,03 mg CO<sub>2</sub>/cm<sup>2</sup>/h erreichen kann. | ||
=== Themenbereich Bodenatmung === | |||
* [http://hypersoil.uni-muenster.de/0/05/16.htm Bodenatmung] | |||
* [http://www.cswh.worldforestry.de/img/08_CSWH-OSNI-C-Boden_Gruenwald.pdf|Bodenatmung in einem Fichtenbestand] | |||
=== Methode der Kohlenstoffdioxidmessung im Freiland === | |||
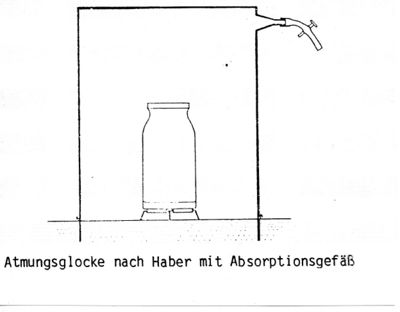
Bodenbürtiges {{wpde|Kohlenstoffdioxid|Kohlenstoffdioxid}} lässt sich nach Haber mit einer Atmungsglocke direkt an der Erdoberfläche messen . Das Verfahren hat den Nachteil, dass eine differenzierte Messung hinsichtlich der Kohlenstoffdioxidproduktion aus der Wurzelatmung und der Kohlenstoffdioxidabgabe aus der bakteriellen Atmung nicht möglich ist. Das Verfahren kennzeichnet nur annähernd die natürliche Kohlenstoffdioxidabgabe, weil die Temperatur, die Bodenfeuchtigkeit und die Diffusionsverhältnisse unter der Atmungsglocke gegenüber der freien Bodenoberfläche erheblich verändert werden. | |||
{| | |||
| | |||
=== Technik des Verfahrens im Freiland === | |||
[[Datei:Atmungsglocke3.jpg|400px|thumb|Atmungsglocke]] | |||
Mit einer Atmungslocke wird eine Bodenfläche (z.B. 1 Quadratmeter Bodenfläche) abgedeckt und das Kohlenstoffdioxid in einem Absorptionsgefäß mit Bariumhydroxid aufgefangen. | Mit einer Atmungslocke wird eine Bodenfläche (z.B. 1 Quadratmeter Bodenfläche) abgedeckt und das Kohlenstoffdioxid in einem Absorptionsgefäß mit Bariumhydroxid aufgefangen. | ||
{{clear}} | |||
=== Kohlenstoffdioxidmessung im Labor === | |||
Das Verfahren hat den Vorteil, dass die Faktoren Temperatur, Feuchtigkeit und Belüftung kontrolliert werden können. Es demonstriert dennoch nur annähernd die natürliche Kohlenstoffdioxidabgabe eines Bodens bei gegebener Temperatur und Bodenfeuchtigkeit, weil beim Experiment in einem geschlossenen Gefäß Sauerstoffmangel auftreten kann, welcher einen wesentlichen Einfluss auf die Intensität der Atmung einer Bodenprobe ausüben kann. Durch zusätzliche Belüftung kann dieser Störfaktor gemindert werden, wobei das Resultat davon abhängt, ob kohlenstoffdioxidhaltige oder kohlenstoffdioxidfreie Luft zugeführt wird. Das Laborverfahren gestattet Versuchsvarianten mit Bodenzusätzen (Glukose; Zellulose; Ammoniumnitrat etc.). | |||
=== Technik des Verfahrens im Labor === | |||
[[Datei:Weckglas1.jpg|150px|thumb|'''Weckglas''']] | |||
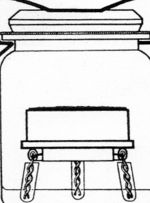
Man bringt eine Bodenprobe, deren Masse oder Volumen man bestimmt hat, in einen geschlossenen Raum. Das aus der Probe austretende Kohlenstoffdioxid wird in einem Absorptionsgefäß aufgefangen. Man kann Bodenproben einsetzen, die man soeben am Standort ausgestochen hat; man kann aber auch durch Siebung die Feinwurzeln entfernen und damit die Wurzelatmung ausschalten. | |||
Ein geschlossener Raum lässt sich gut mit einem Weckglas realisieren. | |||
Eine einfache Methode des Kohlenstoffdioxidnachweises ist die Bestimmung in einem geschlossenen Gefäß, in dem das Kohlenstoffdioxid in Bariumhydroxidlösung aufgefangen wird. Es bildet sich Bariumcarbonat. Nachfolgend wird die unverbrauchte Lauge gegen Salzsäure (oder Oxalsäure) rücktitriert. | Eine einfache Methode des Kohlenstoffdioxidnachweises ist die Bestimmung in einem geschlossenen Gefäß, in dem das Kohlenstoffdioxid in Bariumhydroxidlösung aufgefangen wird. Es bildet sich Bariumcarbonat. Nachfolgend wird die unverbrauchte Lauge gegen Salzsäure (oder Oxalsäure) rücktitriert. | ||
=== Kohlenstoffdioxidmessung im Labor === | |||
==== Formeln ==== | |||
<math>\mathrm{Ba(OH)_2 + CO_2 \longrightarrow BaCO_3 \downarrow + H_2O}</math> | |||
<math>\mathrm{Ba(OH)_2 + 2HCl\longrightarrow BaCl2 \downarrow + 2H_2O}</math> | |||
''' | ==== Untersuchungsmaterialien ==== | ||
* [http://de.wikipedia.org/wiki/Exsikkator_(Chemie) '''Exsikkator'''] | |||
* Waage | |||
* schalenförmiges Gefäß (250 ml) für die Bodenprobe | |||
* schalenförmiges Gefäß (200 ml) für die Bariumhydroxidlösung | |||
* Sieb (2 mm Maschenweite) | |||
* Bürette | |||
* Pipetten | |||
==== REAGENZIEN ==== | |||
[[Datei:Phenolphthalein2.svg|thumb|200px|Phenolphthalein (Strukturformel)]] | |||
*Bariumhydroxid {Ba(OH)<sub>2</sub> ·H<sub>2</sub>O | *Bariumhydroxid {Ba(OH)<sub>2</sub> ·H<sub>2</sub>O | ||
| Zeile 172: | Zeile 91: | ||
*0,1 m, 0,01 m oder 0,02 m Salzsäure | *0,1 m, 0,01 m oder 0,02 m Salzsäure | ||
*Phenolphthalein (1 prozentig in Ethanol) | * {{wpde|Phenolphthalein|Phenophthalein}} (1 prozentig in Ethanol) | ||
==== Herstellung der Bariumhydroxidlösung ==== | |||
7,17 g Bariumhydroxid und 1 g Bariumchlorid werden in destilliertem Wasser gelöst (auffüllen bis zur 1000 ml Marke). Vom Ungelösten wird abfiltriert. Zur Aufbewahrung der Bariumhydroxidlösung empfiehlt sich eine spezielle Vorrichtung. | 7,17 g {{wpde|Bariumhydroxid|Bariumhydroxid}} und 1 g {{wpde|Bariumchlorid|Barumchlorid}} werden in destilliertem Wasser gelöst (auffüllen bis zur 1000 ml Marke). Vom Ungelösten wird abfiltriert. Zur Aufbewahrung der Bariumhydroxidlösung empfiehlt sich eine spezielle Vorrichtung. | ||
Gefäß zur Aufbewahrung von Bariumhydroxidlösung in kohlenstoffdioxidfreier Atmosphäre. Natronkalk ist ein Gemisch aus Ätznatron und Ätzkalk. Er entsteht, wenn man gebrannten Kalk mit Natronlauge löscht. | Gefäß zur Aufbewahrung von Bariumhydroxidlösung in kohlenstoffdioxidfreier Atmosphäre. Natronkalk ist ein Gemisch aus Ätznatron und Ätzkalk. Er entsteht, wenn man gebrannten Kalk mit Natronlauge löscht. | ||
[[Datei:Bariumhydroxidlösung.jpg|400px|center]] | |||
{{clear}} | |||
=== Versuchsablauf === | |||
Eine Probe naturfeuchten Bodens wird gesiebt, wobei neben den Grobteilen die Feinwurzeln zum größten Teil entfernt werden. 250 g des gesiebten Bodens werden in eine Schale eingewogen und auf den gelochten Porzellaneinsatz im Exsikkator gestellt. 125 ml Bariumhydroxidlösung werden in ein schalenförmiges Gefäß gefüllt und unter die Bodenprobe deponiert. Die Bodenprobe soll möglichst nahe über dem Flüssigkeitsspiegel der Bariumhydroxidlösung stehen. Der Exsikkator wird nun verschlossen. In der Regel sollten mindestens drei Proben und eine Blindprobe ausgewertet werden. Eine Blindprobe , also ein Versuch, bei dem kein Boden eingesetzt wird, ist zwingend erforderlich, um den ursprünglichen Gehalt der Bariumhydroxidlösung an Kohlenstoffdioxid zu bestimmen. | |||
Je nach Aufgabenstellung bleibt die Probe einige Stunden, einen Tag oder maximal eine Woche lang bei Zimmertemperatur stehen. Parallel zur Kohlenstoffdioxid-Messung wird der | Je nach Aufgabenstellung bleibt die Probe einige Stunden, einen Tag oder maximal eine Woche lang bei Zimmertemperatur stehen. Parallel zur Kohlenstoffdioxid-Messung wird der | ||
Wassergehalt der Bodenprobe ermittelt (siehe Kapitel [[Wir erforschen den Boden/Bestimmung der Trockensubstanz einer Bodenprobe| | Wassergehalt der Bodenprobe ermittelt (siehe Kapitel [[Wir erforschen den Boden/Bestimmung der Trockensubstanz einer Bodenprobe| Bestimmung der Trockensubstanz einer Bodenprobe]]). | ||
Die unverbrauchte Bariumhydroxidlösung wird mit Salzsäure zurücktitriert. Als Indikator werden 3 Tropfen Phenolphthaleinlösung zugesetzt. Der Versuch kann bei Bedarf fortgesetzt werden, indem - jeweils nach Deponierung neuer Bariumhydroxidlösung - die Kohlenstoffdioxidabgabe über weitere Zeiträume verfolgt wird. | Die unverbrauchte Bariumhydroxidlösung wird mit Salzsäure zurücktitriert. Als Indikator werden 3 Tropfen Phenolphthaleinlösung zugesetzt. Der Versuch kann bei Bedarf fortgesetzt werden, indem - jeweils nach Deponierung neuer Bariumhydroxidlösung - die Kohlenstoffdioxidabgabe über weitere Zeiträume verfolgt wird. | ||
=== Messung, Auwertung, Auswertungsbeispiel === | |||
==== Messung ==== | |||
Zur Auswertung wird der Säureverbrauch der Blindprobe vom Säureverbrauch der Bodenprobe subtrahiert. Die Differenz wird mit dem Auswertungsfaktor multipliziert. | Zur Auswertung wird der Säureverbrauch der Blindprobe vom Säureverbrauch der Bodenprobe subtrahiert. Die Differenz wird mit dem Auswertungsfaktor multipliziert. | ||
1 ml 0,1 m HCl entspricht 2,2 mg CO<sub>2</sub> | 1 ml 0,1 m HCl entspricht 2,2 mg CO<sub>2</sub> | ||
1 ml 0,02 m HCl entspricht 4,4 mg CO<sub>2</sub> | 1 ml 0,02 m HCl entspricht 4,4 mg CO<sub>2</sub> | ||
==== Auswertungsbeispiel ==== | |||
Kohlenstoffdioxidabgabe von 250 g frischem Boden in 24 Stunden: | Kohlenstoffdioxidabgabe von 250 g frischem Boden in 24 Stunden: | ||
*a) | *a) Blindprobe : Es wurden 20 ml 0,02 m Salzsäure verbraucht | ||
*b) Bodenprobe (Ackererde), feucht, 250 g: Es wurden 13 ml 0,02 m Salzsäure verbraucht. | |||
*b) | |||
*20 ml HCl - 13 ml HCl = 7 ml HCI . 0,44 mg CO<sub>2</sub> = 3,08 mg CO<sub>2</sub> Abgabe in 24 Stunden | *20 ml HCl - 13 ml HCl = 7 ml HCI . 0,44 mg CO<sub>2</sub> = 3,08 mg CO<sub>2</sub> Abgabe in 24 Stunden | ||
*3,08 mg CO<sub>2</sub> /2,5 = 1,23 mg CO<sub>2</sub>Abgabe je 100 g Boden in 24 Stunden. | |||
*3,08 mg CO<sub>2</sub> /2,5 = 1,23 mg CO<sub>2</sub>Abgabe je 100 g Boden in 24 Stunden. | |||
==== Umrechnung auf die Kohlenstoffdioxidproduktion eines Hektars: ==== | |||
Ein Hektar Mineralboden wiegt bis zu einer Bodentiefe von 30 cm ca. 3000 000 kg. | Ein Hektar Mineralboden wiegt bis zu einer Bodentiefe von 30 cm ca. 3000 000 kg. | ||
12,3 mg Kohlenstoffdioxid-Abgabe je Kilogramm Boden und Tag x 3000 000 kg/ha = 36 900 000 mg CO<sub>2</sub> /ha/ Tag = 36,9 kg Kohlenstoffdioxid-Abgabe je Hektar und Tag. | 12,3 mg Kohlenstoffdioxid-Abgabe je Kilogramm Boden und Tag x 3000 000 kg/ha = 36 900 000 mg CO<sub>2</sub> /ha/ Tag = 36,9 kg Kohlenstoffdioxid-Abgabe je Hektar und Tag. | ||
==== Die Titration mit {{wpde|Oxalsäure|Oxalsäure}} ==== | |||
[[File:Oxalsäure2.svg|thumb|300px]] | |||
* Gewicht der Bodenprobe: 100 g | |||
* Zeitraum für die Kohlenstoffdioxid - Anreicherung: 24 h | |||
*Gewicht der Bodenprobe: 100 g | |||
*Zeitraum für die Kohlenstoffdioxid - Anreicherung: 24 h | |||
Eingegebene Menge Bariumhydroxidlösung: 25 ml | Eingegebene Menge Bariumhydroxidlösung: 25 ml | ||
| Zeile 267: | Zeile 151: | ||
*a) Verbrauch an Oxalsäure für die Blindprobe: 20 ml | *a) Verbrauch an Oxalsäure für die Blindprobe: 20 ml | ||
*b) Verbrauch an Oxalsäure für die Bodenprobe : 14 ml | *b) Verbrauch an Oxalsäure für die Bodenprobe : 14 ml | ||
(20 ml - 14 ml) x 2,2 = 13,2 mg CO<sub>2</sub> / 100g Boden in 24 Stunden | (20 ml - 14 ml) x 2,2 = 13,2 mg CO<sub>2</sub> / 100g Boden in 24 Stunden | ||
=== Erfahrungen und Konsequenzen === | |||
In der Literatur werden häufig nur 10 g Boden für eine Bodenprobenmenge angegeben. Bei einfacher Laborausstattung ist es zweckmäßig, die Bodenmenge auf 200 oder 250 g zu erhöhen. Bei mehrtägiger Versuchsdauer sollte die Bariumhydroxidlösung gelegentlich leicht geschüttelt werden, um die Bildung einer absorptionshemmenden Carbonathaut auf der Lösung zu verhindern. Anstelle von Salzsäure und Oxalsäure können auch andere eingestellte Säuren für die Titration verwendet werden. | |||
Fertige Bariumhydroxidlösung ist auch im Handel erhältlich! | |||
{{Box|Sicherheitshinweis| | |||
Oxalsäure ist giftig! Die Verwendung von Pipettierhilfen ist zu kontrollieren!|Hervorhebung2}} | |||
[[Bild:Pseudoscops clamator.jpg|100px|thumb|left|Pseudoscops clamator]] | |||
=== Fragen und Antworten in einem Chemie-Forum === | |||
'''Petra''' | |||
....Hallo zusammen,folgenden Versuch haben wir diese Woche ausgeführt:}} | >> ....Hallo zusammen,folgenden Versuch haben wir diese Woche ausgeführt:}} | ||
Gazebeutel mit 50g Erde binden, diesen in ein Konservenglas, das mit 30ml NaOH (c= 0.1mol/l) beschtickt ist, einhängen. 3 Tropfen Phenolphtalein zugeben | >> Gazebeutel mit 50g Erde binden, diesen in ein Konservenglas, das mit 30ml NaOH (c= 0.1mol/l) beschtickt ist, | ||
>> einhängen. 3 Tropfen Phenolphtalein zugeben. | |||
( | >> Nach 24h den Gazebeutel entfernen, die Natronlauge in ein Becherglas geben, nochmals Phenolphtalein zugeben, mit HCL > (0.1 m/l) titrieren. | ||
>> (1ml NaOH bindet 4.4ml CO2) | |||
{{Box|Zu meinen Fragen:| | |||
a) Also, was geschieht eigentlich genau? Wie sieht die Reaktionsgleichung aus? | a) Also, was geschieht eigentlich genau? Wie sieht die Reaktionsgleichung aus? | ||
Also CO2 entsteht bei der Atmung der Mikroorganismen in der Erde, aber was genau hat NaOH damit zu tun? | Also CO2 entsteht bei der Atmung der Mikroorganismen in der Erde, aber was genau hat NaOH damit zu tun? | ||
| Zeile 320: | Zeile 190: | ||
Was bedeutet das aber genau? | Was bedeutet das aber genau? | ||
'''Danke schon im voraus für eure Hilfe!''' | |||
|Frage}} | |||
> '''Julia ..............''' | |||
'''Julia ..............''' | > '''Hallo''' | ||
'''Hallo''' | |||
die Natronlauge "bindet" Kohlendioxid, indem sich Natriumcarbonat bildet : | > die Natronlauge "bindet" Kohlendioxid, indem sich Natriumcarbonat bildet : | ||
2 NaOH + CO2 = Na2 CO3 +H2 O | > 2 NaOH + CO2 = Na2 CO3 +H2 O | ||
Du weisst, welche Stoffmenge NaOH du ins Glas gegeben hast (Volumen und Konzentration sind bekannt). | > Du weisst, welche Stoffmenge NaOH du ins Glas gegeben hast (Volumen und Konzentration sind bekannt). | ||
Durch die Titration bestimmst du, wieviel NaOH davon noch übrig ist. Dazu musst du wissen, wie NaOH mit HCl reagiert...die Stoffmenge HCl, die du zur Neutralisation der restlichen NaOH zugeben musst errechnet sich ja auch aus deren bekannter Konzentration und dem an der Bürette abgelesenen Volumen. | > Durch die Titration bestimmst du, wieviel NaOH davon noch übrig ist. Dazu musst du wissen, wie NaOH mit HCl reagiert...die Stoffmenge HCl, die du zur Neutralisation der restlichen NaOH zugeben musst errechnet sich ja auch aus deren bekannter Konzentration und dem an der Bürette abgelesenen Volumen. | ||
Die Differenz zwischen der ursprünlgich zugegebenen NaOH und der rücktitrierten Menge sagt dir dann, wieviel NaOH für das Binden des CO2 verbraucht wurde. Und da du auch, siehe 1. Gleichung, weisst, wie NaOH mit CO2 reagiert, kannst du die Stoffmenge CO2 berechnen, die deine Bodenprobe in der gesetzten Zeit, freigegesetzt hat... | > Die Differenz zwischen der ursprünlgich zugegebenen NaOH und der rücktitrierten Menge sagt dir dann, wieviel NaOH für das Binden des CO2 verbraucht wurde. Und da du auch, siehe 1. Gleichung, weisst, wie NaOH mit CO2 reagiert, kannst du die Stoffmenge CO2 berechnen, die deine Bodenprobe in der gesetzten Zeit, freigegesetzt hat... | ||
'''Vielen Dank für deine Antwort, Julia :) ''' | '''Vielen Dank für deine Antwort, Julia :) ''' | ||
Petra ..... | |||
Das bedeutet also, dass nach den 24 h noch 5.2 ml 0.1M NaOH vorhanden waren. | Das bedeutet also, dass nach den 24 h noch 5.2 ml 0.1M NaOH vorhanden waren. | ||
(da mit 0.1 M HCl titirert 5.2 ml}} | (da mit 0.1 M HCl titirert 5.2 ml}} | ||
| Zeile 346: | Zeile 216: | ||
also hat unsere Bodenprobe in 24 h 24.8*4.4= 109.1 ml CO2 freigesetzt...... | also hat unsere Bodenprobe in 24 h 24.8*4.4= 109.1 ml CO2 freigesetzt...... | ||
{{Box|Frage|Stimmt die Rechnung?|Frage}} | |||
=== Literaturhinweise === | |||
1. Das Projektvorhaben [http://hypersoil.uni-muenster.de/ "HyperSoil"] wurde im Ausschreibungsschwerpunkt "Hochschulen in multimedialen Netzwerken - Neue Medien in Schulen und Hochschulen" vom Kompetenznetzwerk Universitätsverbund MultiMedia NRW (UVM) gefördert (s. Projektpartner). | |||
*Förderzeitraum: 1. Mai 2001 bis 31. Dezember 2002 | :*Förderzeitraum: 1. Mai 2001 bis 31. Dezember 2002 | ||
:*Projektleitung: PD Dr. Gesine Hellberg-Rode | |||
:*Institut für Didaktik der Biologie | |||
:*Westfälische Wilhelms-Universität Münster | |||
:*Kooperationspartner: HD Dr. Karl-Heinz Otto | |||
:*Institut für Geographie und ihre Didaktik Universität Dortmund | |||
:* Heike Schleithoff Fachleiterin für das Fach Sachunterricht, Studienseminar für das Lehramt für die Primarstufe - Münster | |||
2. ''' Prof. Dr. Gerhard Geisler''', '''Pflanzenbau'''. Verlag Paul Parexy. Berlin und Hamburg 1989 | |||
{{Boden}} | |||
Aktuelle Version vom 25. Februar 2019, 04:07 Uhr
Kohlenstoffdioxid entsteht im Boden hauptsächlich durch die Mikroorganismenatmung (zu zwei Dritteln) und durch die Wurzelatmung (zu einem Drittel). Abiotische Kohlenstoffdioxidbildungen können in der Regel vernachlässigt werden. Das Kohlenstoffdioxid tritt an die Erdoberfläche und reichert die umgebende Luft an. In einem Kulturpflanzenbestand liegt die Kohlenstoffdioxidkonzentration in der Luft bei etwa 0,038 Volumenprozent, wobei erhebliche Schwankungen festgestellt wurden (0,025 bis 0,05 Volumenprozent), die als standortspezifisch anzusehen sind.
| Standort | CO2 /m²/h |
|---|---|
| Pflanzengesellschaft | (mg) |
| unbewachsener Sandboden | 89 |
| Kiefernwald | 157 |
| Fichtenwald | 360 |
| Buchenwald | 407 |
| Rübenacker | 419 |
| Goldhafenwiese | 866 |
Mit der Bodenatmung wird dem Pflanzenbestand eine gewisse Menge Kohlenstoffdioxid zugeführt. Diese dürfte aber 10 bis 20% der insgesamt von den Pflanzen verbrauchten Menge nicht überschreiten. Geht man von einem Kulturpflanzenbestand mit einer mittleren Assimilationsintensität von 0,2 mg CO2/cm2/h aus, steht dem eine Bodenatmung gegenüber, die etwa 0,03 mg CO2/cm2/h erreichen kann.
Themenbereich Bodenatmung
Methode der Kohlenstoffdioxidmessung im Freiland
Bodenbürtiges Kohlenstoffdioxid![]() lässt sich nach Haber mit einer Atmungsglocke direkt an der Erdoberfläche messen . Das Verfahren hat den Nachteil, dass eine differenzierte Messung hinsichtlich der Kohlenstoffdioxidproduktion aus der Wurzelatmung und der Kohlenstoffdioxidabgabe aus der bakteriellen Atmung nicht möglich ist. Das Verfahren kennzeichnet nur annähernd die natürliche Kohlenstoffdioxidabgabe, weil die Temperatur, die Bodenfeuchtigkeit und die Diffusionsverhältnisse unter der Atmungsglocke gegenüber der freien Bodenoberfläche erheblich verändert werden.
lässt sich nach Haber mit einer Atmungsglocke direkt an der Erdoberfläche messen . Das Verfahren hat den Nachteil, dass eine differenzierte Messung hinsichtlich der Kohlenstoffdioxidproduktion aus der Wurzelatmung und der Kohlenstoffdioxidabgabe aus der bakteriellen Atmung nicht möglich ist. Das Verfahren kennzeichnet nur annähernd die natürliche Kohlenstoffdioxidabgabe, weil die Temperatur, die Bodenfeuchtigkeit und die Diffusionsverhältnisse unter der Atmungsglocke gegenüber der freien Bodenoberfläche erheblich verändert werden.
Technik des Verfahrens im Freiland
Mit einer Atmungslocke wird eine Bodenfläche (z.B. 1 Quadratmeter Bodenfläche) abgedeckt und das Kohlenstoffdioxid in einem Absorptionsgefäß mit Bariumhydroxid aufgefangen.
Kohlenstoffdioxidmessung im Labor
Das Verfahren hat den Vorteil, dass die Faktoren Temperatur, Feuchtigkeit und Belüftung kontrolliert werden können. Es demonstriert dennoch nur annähernd die natürliche Kohlenstoffdioxidabgabe eines Bodens bei gegebener Temperatur und Bodenfeuchtigkeit, weil beim Experiment in einem geschlossenen Gefäß Sauerstoffmangel auftreten kann, welcher einen wesentlichen Einfluss auf die Intensität der Atmung einer Bodenprobe ausüben kann. Durch zusätzliche Belüftung kann dieser Störfaktor gemindert werden, wobei das Resultat davon abhängt, ob kohlenstoffdioxidhaltige oder kohlenstoffdioxidfreie Luft zugeführt wird. Das Laborverfahren gestattet Versuchsvarianten mit Bodenzusätzen (Glukose; Zellulose; Ammoniumnitrat etc.).
Technik des Verfahrens im Labor
Man bringt eine Bodenprobe, deren Masse oder Volumen man bestimmt hat, in einen geschlossenen Raum. Das aus der Probe austretende Kohlenstoffdioxid wird in einem Absorptionsgefäß aufgefangen. Man kann Bodenproben einsetzen, die man soeben am Standort ausgestochen hat; man kann aber auch durch Siebung die Feinwurzeln entfernen und damit die Wurzelatmung ausschalten.
Ein geschlossener Raum lässt sich gut mit einem Weckglas realisieren.
Eine einfache Methode des Kohlenstoffdioxidnachweises ist die Bestimmung in einem geschlossenen Gefäß, in dem das Kohlenstoffdioxid in Bariumhydroxidlösung aufgefangen wird. Es bildet sich Bariumcarbonat. Nachfolgend wird die unverbrauchte Lauge gegen Salzsäure (oder Oxalsäure) rücktitriert.
Kohlenstoffdioxidmessung im Labor
Formeln
Untersuchungsmaterialien
- Exsikkator
- Waage
- schalenförmiges Gefäß (250 ml) für die Bodenprobe
- schalenförmiges Gefäß (200 ml) für die Bariumhydroxidlösung
- Sieb (2 mm Maschenweite)
- Bürette
- Pipetten
REAGENZIEN
- Bariumhydroxid {Ba(OH)2 ·H2O
- Bariumchlorid
- 0,1 m, 0,01 m oder 0,02 m Salzsäure
- Phenophthalein
 (1 prozentig in Ethanol)
(1 prozentig in Ethanol)
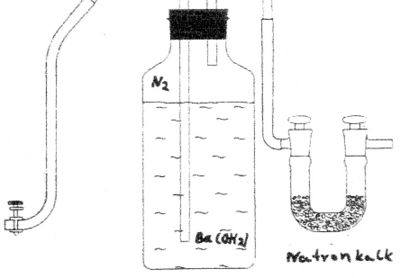
Herstellung der Bariumhydroxidlösung
7,17 g Bariumhydroxid![]() und 1 g Barumchlorid
und 1 g Barumchlorid![]() werden in destilliertem Wasser gelöst (auffüllen bis zur 1000 ml Marke). Vom Ungelösten wird abfiltriert. Zur Aufbewahrung der Bariumhydroxidlösung empfiehlt sich eine spezielle Vorrichtung.
Gefäß zur Aufbewahrung von Bariumhydroxidlösung in kohlenstoffdioxidfreier Atmosphäre. Natronkalk ist ein Gemisch aus Ätznatron und Ätzkalk. Er entsteht, wenn man gebrannten Kalk mit Natronlauge löscht.
werden in destilliertem Wasser gelöst (auffüllen bis zur 1000 ml Marke). Vom Ungelösten wird abfiltriert. Zur Aufbewahrung der Bariumhydroxidlösung empfiehlt sich eine spezielle Vorrichtung.
Gefäß zur Aufbewahrung von Bariumhydroxidlösung in kohlenstoffdioxidfreier Atmosphäre. Natronkalk ist ein Gemisch aus Ätznatron und Ätzkalk. Er entsteht, wenn man gebrannten Kalk mit Natronlauge löscht.
Versuchsablauf
Eine Probe naturfeuchten Bodens wird gesiebt, wobei neben den Grobteilen die Feinwurzeln zum größten Teil entfernt werden. 250 g des gesiebten Bodens werden in eine Schale eingewogen und auf den gelochten Porzellaneinsatz im Exsikkator gestellt. 125 ml Bariumhydroxidlösung werden in ein schalenförmiges Gefäß gefüllt und unter die Bodenprobe deponiert. Die Bodenprobe soll möglichst nahe über dem Flüssigkeitsspiegel der Bariumhydroxidlösung stehen. Der Exsikkator wird nun verschlossen. In der Regel sollten mindestens drei Proben und eine Blindprobe ausgewertet werden. Eine Blindprobe , also ein Versuch, bei dem kein Boden eingesetzt wird, ist zwingend erforderlich, um den ursprünglichen Gehalt der Bariumhydroxidlösung an Kohlenstoffdioxid zu bestimmen.
Je nach Aufgabenstellung bleibt die Probe einige Stunden, einen Tag oder maximal eine Woche lang bei Zimmertemperatur stehen. Parallel zur Kohlenstoffdioxid-Messung wird der Wassergehalt der Bodenprobe ermittelt (siehe Kapitel Bestimmung der Trockensubstanz einer Bodenprobe). Die unverbrauchte Bariumhydroxidlösung wird mit Salzsäure zurücktitriert. Als Indikator werden 3 Tropfen Phenolphthaleinlösung zugesetzt. Der Versuch kann bei Bedarf fortgesetzt werden, indem - jeweils nach Deponierung neuer Bariumhydroxidlösung - die Kohlenstoffdioxidabgabe über weitere Zeiträume verfolgt wird.
Messung, Auwertung, Auswertungsbeispiel
Messung
Zur Auswertung wird der Säureverbrauch der Blindprobe vom Säureverbrauch der Bodenprobe subtrahiert. Die Differenz wird mit dem Auswertungsfaktor multipliziert. 1 ml 0,1 m HCl entspricht 2,2 mg CO2
1 ml 0,02 m HCl entspricht 4,4 mg CO2
Auswertungsbeispiel
Kohlenstoffdioxidabgabe von 250 g frischem Boden in 24 Stunden:
- a) Blindprobe : Es wurden 20 ml 0,02 m Salzsäure verbraucht
- b) Bodenprobe (Ackererde), feucht, 250 g: Es wurden 13 ml 0,02 m Salzsäure verbraucht.
- 20 ml HCl - 13 ml HCl = 7 ml HCI . 0,44 mg CO2 = 3,08 mg CO2 Abgabe in 24 Stunden
- 3,08 mg CO2 /2,5 = 1,23 mg CO2Abgabe je 100 g Boden in 24 Stunden.
Umrechnung auf die Kohlenstoffdioxidproduktion eines Hektars:
Ein Hektar Mineralboden wiegt bis zu einer Bodentiefe von 30 cm ca. 3000 000 kg. 12,3 mg Kohlenstoffdioxid-Abgabe je Kilogramm Boden und Tag x 3000 000 kg/ha = 36 900 000 mg CO2 /ha/ Tag = 36,9 kg Kohlenstoffdioxid-Abgabe je Hektar und Tag.
Die Titration mit Oxalsäure
- Gewicht der Bodenprobe: 100 g
- Zeitraum für die Kohlenstoffdioxid - Anreicherung: 24 h
Eingegebene Menge Bariumhydroxidlösung: 25 ml
1 ml 0,05 n Oxalsäure entspricht 2,2 mg CO2
- a) Verbrauch an Oxalsäure für die Blindprobe: 20 ml
- b) Verbrauch an Oxalsäure für die Bodenprobe : 14 ml
(20 ml - 14 ml) x 2,2 = 13,2 mg CO2 / 100g Boden in 24 Stunden
Erfahrungen und Konsequenzen
In der Literatur werden häufig nur 10 g Boden für eine Bodenprobenmenge angegeben. Bei einfacher Laborausstattung ist es zweckmäßig, die Bodenmenge auf 200 oder 250 g zu erhöhen. Bei mehrtägiger Versuchsdauer sollte die Bariumhydroxidlösung gelegentlich leicht geschüttelt werden, um die Bildung einer absorptionshemmenden Carbonathaut auf der Lösung zu verhindern. Anstelle von Salzsäure und Oxalsäure können auch andere eingestellte Säuren für die Titration verwendet werden. Fertige Bariumhydroxidlösung ist auch im Handel erhältlich!
Oxalsäure ist giftig! Die Verwendung von Pipettierhilfen ist zu kontrollieren!
Fragen und Antworten in einem Chemie-Forum
Petra >> ....Hallo zusammen,folgenden Versuch haben wir diese Woche ausgeführt:}}
>> Gazebeutel mit 50g Erde binden, diesen in ein Konservenglas, das mit 30ml NaOH (c= 0.1mol/l) beschtickt ist, >> einhängen. 3 Tropfen Phenolphtalein zugeben.
>> Nach 24h den Gazebeutel entfernen, die Natronlauge in ein Becherglas geben, nochmals Phenolphtalein zugeben, mit HCL > (0.1 m/l) titrieren.
>> (1ml NaOH bindet 4.4ml CO2)
a) Also, was geschieht eigentlich genau? Wie sieht die Reaktionsgleichung aus? Also CO2 entsteht bei der Atmung der Mikroorganismen in der Erde, aber was genau hat NaOH damit zu tun?
b) Wie kann ich ausrechnen, wieviel CO2 entstanden ist?
Um NaOH zu neutralisieren brauchten wir 5.2 ml HCl. Was bedeutet das aber genau?
Danke schon im voraus für eure Hilfe!
> Julia ..............
> Hallo
> die Natronlauge "bindet" Kohlendioxid, indem sich Natriumcarbonat bildet :
> 2 NaOH + CO2 = Na2 CO3 +H2 O
> Du weisst, welche Stoffmenge NaOH du ins Glas gegeben hast (Volumen und Konzentration sind bekannt).
> Durch die Titration bestimmst du, wieviel NaOH davon noch übrig ist. Dazu musst du wissen, wie NaOH mit HCl reagiert...die Stoffmenge HCl, die du zur Neutralisation der restlichen NaOH zugeben musst errechnet sich ja auch aus deren bekannter Konzentration und dem an der Bürette abgelesenen Volumen.
> Die Differenz zwischen der ursprünlgich zugegebenen NaOH und der rücktitrierten Menge sagt dir dann, wieviel NaOH für das Binden des CO2 verbraucht wurde. Und da du auch, siehe 1. Gleichung, weisst, wie NaOH mit CO2 reagiert, kannst du die Stoffmenge CO2 berechnen, die deine Bodenprobe in der gesetzten Zeit, freigegesetzt hat...
Vielen Dank für deine Antwort, Julia :) Petra ..... Das bedeutet also, dass nach den 24 h noch 5.2 ml 0.1M NaOH vorhanden waren. (da mit 0.1 M HCl titirert 5.2 ml}}
24.8 ml wurden also mit CO2 "gebunden",
also hat unsere Bodenprobe in 24 h 24.8*4.4= 109.1 ml CO2 freigesetzt......
Literaturhinweise
1. Das Projektvorhaben "HyperSoil" wurde im Ausschreibungsschwerpunkt "Hochschulen in multimedialen Netzwerken - Neue Medien in Schulen und Hochschulen" vom Kompetenznetzwerk Universitätsverbund MultiMedia NRW (UVM) gefördert (s. Projektpartner).
- Förderzeitraum: 1. Mai 2001 bis 31. Dezember 2002
- Projektleitung: PD Dr. Gesine Hellberg-Rode
- Institut für Didaktik der Biologie
- Westfälische Wilhelms-Universität Münster
- Kooperationspartner: HD Dr. Karl-Heinz Otto
- Institut für Geographie und ihre Didaktik Universität Dortmund
- Heike Schleithoff Fachleiterin für das Fach Sachunterricht, Studienseminar für das Lehramt für die Primarstufe - Münster
2. Prof. Dr. Gerhard Geisler, Pflanzenbau. Verlag Paul Parexy. Berlin und Hamburg 1989
Einfache Analyseverfahren
Organische Zusammensetzung
- Humusanteil
- Bakterienkunde
- Lichtmikroskop
- Plattengussverfahren
- Bakterienkeimzahl
- Bodenpilze
- Kohlenstoffdioxidbildung
- Regenwurm
Bodenwasser, -luft, -wärme
Bodenreaktion