Wir erforschen den Boden/Wir messen die Bodenversauerung elektrometrisch
Aus ZUM-Unterrichten
Wir erforschen den Boden
Einfache Analyseverfahren
Organische Zusammensetzung
- Humusanteil
- Bakterienkunde
- Lichtmikroskop
- Plattengussverfahren
- Bakterienkeimzahl
- Bodenpilze
- Kohlenstoffdioxidbildung
- Regenwurm
Bodenwasser, -luft, -wärme
Bodenreaktion
}
Wir messen die Bodenversauerung elektrometrisch
|
Informationen zum Thema
|
| Der pH-Wert eines Bodens kann (entsprechend der angewandten Methode) verschieden aus. Daher muss die Art seiner Bestimmung stets angegeben werden. Dazu gehören: |
| 1. Bestimmung frischer oder getrockneter Proben |
| 2. Zusatz von Salzlößungen (Kaliumchlorid) |
| 3. Verhältnis Boden : Wasser |
| 4. Messverfahren und Gerätetyp |
| 5. Messungen in Suspensionen, überstehender Flüssigkeit o. dgl. |
| Hinzu kommen Angaben über den Zeitpunkt und die Tiefe der Probennahme und darüber, ob sich die Werte auf Einzel- oder Mischproben beziehen. Für pflanzenökologische Zwecke ist nur der in einer wässrigen Bodensuspension gemessene pH-Wert = pH (H20) brauchbar, da er den natürlichen Verhältnissen am besten entspricht. Von bodenkundlicher und agrikulturchemischer Seite wird dagegen die Probe in einer Salzlösung (meist n-KCl oder 0,1nKCl) aufgeschwemmt. Konventionell sind Boden und Flüssigkeit im Verhältnis 1 : 2,5 (bei humosen Böden 1 :10) zu mischen. |
|
Untersuchungsmaterialien</div |
|
pH-Meter (elektrisch)
|
Versuchsablauf</div |
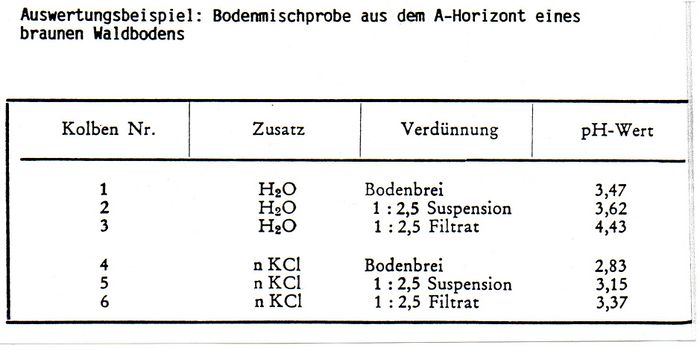
| In sechs nummerierte Gefäße werden je 10 g (oder 20 g) Boden eingewogen. In die Gefäße Nr. 2 + 3 werden 25 ml destilliertes Wasser und in die Gefäße Nr. 5 + 6 je 25 ml einmolare Kaliumchloridlösung gegeben, so dass ein gut rührbarer Bodenbrei entsteht. Der Inhalt der Gefäße Nr. 2 + 3 + 5 + 6 wird gut umgerührt. Danach werden Lösungen Nr. 3 + 6 vom Bodensatz abfiltriert. Nach zehn Minuten erfolgt die pH-Messung im Bodenbrei, in der Bodenaufschwemmung und im Bodenfiltrat. Nach jeder Messung ist die Elektrode mit destilliertem Wasser bzw. Kaliumchloridlßsung gut abzuspülen. |
|
pH-KCl</div |
| pH (KCl) liegt in sauren Böden tiefer, in basischen hßher als der pH (H20). Die Ursache ist darin zu suchen, dass die mit der Salzlßsung zugefügten Kationen gegen einen Teil der Hydroxionium-Ionen aus dem Ionenschwarm der Bodenkolloide ausgetauscht werden. Die somit freigesetzten Hydroxonium-Ionen erniedrigen damit den pH-Wert. |
| Umgekehrt werden in neutralen Böden Hydroxid-Ionen freigesetzt. Mit steigendem Flüssigkeitszusatz erhöht sich in sauren Bßden der pH-Wert (in alkalischen wird er erniedrigt). Geringer Wasserzusatz (Brei) entspricht am besten den Standortverhältnissen: Die an den suspendierten Bodenteilchen adsorbierten Hydroxonium- bzw. Hydroxid-Ionen werden dann noch mit in die Reaktion einbezogen, während im Filtrat nur die tatsachlich abgespaltenen Hydroxonlum- bzw. Hydroxid-Ionen erfasst werden. |
Hinweis zu dem Hydroxid-Ion = Anion = OH-und dem Hydroxonium-Ion zu
|