Benutzer:BirgitLachner/Chemie-Buch I zum Lehrplan in Rheinland-Pfalz/Vom Erz zum Metall/Von Rennofen bis Hochofen
Die Hethiter kannten die Verarbeitung von Eisen zu einer Zeit, als es in anderen Regionen der Welt noch unbekannt war. Mit dem Ende des hethitischen Reiches (um 1200 v. Chr.) endete auch das Monopol dieses Reiches auf die Verhüttung von Eisen, die dort seit dem 17. Jahrhundert v. Chr. belegt ist. Nach dem 12. Jahrhundert v. Chr. breitete sich diese Technik im Vorderen Orient und im Mittelmeerraum aus.
Betrachtung der chemischen Reaktionen im Rennofen
- unedlen Metallen ist stark exotherm
- edlen Metallen ist nur schwach exotherm
Moderne Eisengewinnung im Hochofen
Videos zur Funktionsweise des Hochofens:
Der Wikipedia-Artikel Hochofen![]() liefert auch viele Bilder von alten Hochöfen und der Eisengewinnung von vor 150 Jahren.
liefert auch viele Bilder von alten Hochöfen und der Eisengewinnung von vor 150 Jahren.
Wer Lust auf einen Sonntagsausflug zum Thema "Eisen" hat, kann die Völklinger Hütte besuchen [1]. Auf einem Rundweg durch das inzwischen stillgelegte Werk, das zu einem Weltkulturerbe der UNESCO ernannt wurde, kann man einen Blick in die Geschichte der Eisengewinnung werfen.
Stahlarten
Wer Interesse hat, kann sich mit den verschiedenen Arten an Stahl in einer virtuelle Stahlschmiede beschäftigen.
- Schwert, Schraubenschlüssel, Bratpfanne - Stahl ist nicht gleich Stahl. Eisen- und Stahlsorten haben sehr verschiedene Eigenschaften. Der Kohlenstoffgehalt und die Art der Legierung bestimmen, ob ein Stahl hart, zäh, verformbar, verschleißfest, elastisch oder rostfrei ist. Welcher Stahl für ein Produkt der richtige ist, lässt sich mit dem virtuellen Stahllabor ermitteln. → zur Interaktive Stahlschmiede
Unterscheidung verschiedener Erze
Zur Gewinnung von Metallen werden verwendeten Erze verwendet, bei denen es sich um verschiedene Verbindungen handelt. Meist sind es Verbindungen mit Sauerstoff, also die Oxide, und mit Schwefel, also Sulfide.
Die wichtigsten Eisenverbindungen und Kupferverbindungen sind ...
Wie du siehst, gibt es viele verschiedene Verbindungen von Kupfer und Schwefel. Glücklicherweise müssen wir uns nicht alle Namen merken. Du hast ja bereits kennengelernt, wie man Stoffe aufgrund der Formel - die Verhältnis der Atome in der Verbindung zueinander angibt - benennen kann. Dies sollst du nun noch vertiefen und sichern.
Die Thermitreaktion im Schienenbau
Ein paar Eisenbahn-Fans haben netterweise im Rahmen einer Reihe von Filmen zur Gleisbautechnik auch einen wirklich guten Film zum Schweißen von Schienen erstellt und veröffentlicht.
Wir schauen uns den Film mal an und versuchen herauszubkommen, welche chemische Reaktion da dahinter steckt.
Bei der Thermitreaktion handelt es sich wieder um Redoxreaktion. Das hast du mit geübtem Auge vielleicht schon erkannt und es ist ja auch im Film erwähnt worden. Wir wollen uns nun im folgenden darum kümmern wieder zu verstehen, warum sie funktioniert und - damit wir sie selber durchführen können - auch überlegen, wieviel der Edukte zusammengegeben werden müssen, damit ich ein stöchiometrisches Gemisch bekomme. Denn im Gegensatz zum Hochofen, wo das gasförmige Kohlenmonoxid den Hochofen einfach durchströmt und überall da hin kann wo es gebraucht wird, muss hier darauf geachtet werden, dass die Edukte gleich am Anfang im richtigen Verhältnis gemischt werden. Sonst läuft die Reaktion nämlich erst gar nicht ab.
Die Thermitreaktion in der Theorie - Energiebetrachtung
Stelle an der Reaktionsgleichung zur Thermitreaktion wieder fest ...
- Wo die Oxidation stattfindet.
- Wo die Reduktion stattfindet.
- Was das Oxidations- und was das Reduktionsmittel ist.
- Wie es mit der Energie ist?
Bei unseren bisherigen Redoxreaktionen sind bisher immer Nichtmetalle (wie Kohlenstoff, Wasserstoff) oder Kohlenmonoxid als Reduktionsmittel eingesetzt worden. Die Aufgabe des Reduktionsmittel ist es unter anderem, die notwendige Energie für die Zerlegung des Metalloxids zu liefern, von dem wir das reine Metall haben wollen. Bei der Thermit-Reaktion wird nun Aluminium eingesetzt. Es ist dafür gut geeignet, da Aluminium ein recht unedles Metall ist und wir hatten schon vorher immer wieder festgestellt:
Ordnet man alle Metalle nach der Heftigkeit ihrer Reaktion, so bekommt man die sogenannte Redoxreihe der Metalle.
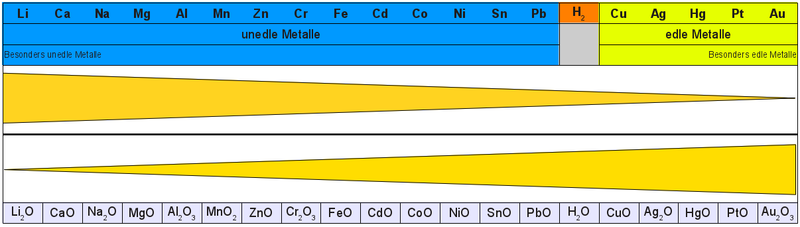
Betrachten wir die Thermit-Reaktion nun noch mal unter Verwendung der Redoxreihe der Metalle:
- Eisenoxid + Aluminium → Eisen + Alumniumoxid
- Aluminium ist ein unedleres Metall als Eisen.
- Bei der Oxidation von Aluminium wird mehr Energie frei als bei der Oxidation von Eisen.
- Für die Reduktion von Eisenoxid wird also umgekehrt weniger Energie benötigt, als bei der Oxidation von Aluminium frei wird.
- Deshalb kann Aluminium als Reduktionsmittel für Eisenoxid verwendet werden!
Überlege, welche der Redoxreaktionen möglich ist, indem du überlegst, welches der Metalle edler bzw. unedler ist. Gehe dabei folgendermaßen vor:
- Schreibe die Reaktionsschemata ins Heft.
- Markiere dazu immer auch die Teilreaktion durch seitliche Pfeile.
- Entscheide anhand der Redoxreihe der Metalle, ob die Reaktion stattfinden kann oder nicht. Liefert also das Oxidationsmittel genügend Energie, um das Oxid zu zerlegen?
- "Kreuze" dann deine Antwort im Multiple-Choice-Test ab und lass nach den ersten drei Aufgaben deine Lösungen kontrollieren.
- Wiederholungen zum Thema Redoxreaktion: Wenn du noch einmal die alten Übungen zu den Redoxreaktionen bearbeiten willst, hier die Links: Lückentext - vervollständige_die_Redoxreaktion / Redoxreaktionen - Kontrolle mit Lückentext / Bilderrätsel zu Energie-Diagrammen bei Redoxreaktionen / Multiple-Choice-Tests zu Redoxreaktion (mit Videos)
Die Thermitreaktion in der Theorie - Quantitative Betrachtung
- Qualitativ = Man betrachtet nur die Stoffe, die an einer Reaktion beteiligt sind. Auf die Menge kommt es nicht an.
- Quantitativ = Man betrachtet die Menge der Stoffe, die an einer Reaktion beteiligt sind.
Damit die Thermitreaktion, die wir selber durchführen wollen auch wirklich abläuft, müssen wir möglichst genau wissen, wieviel Gramm vom Eisenoxid und wieviel Gramm vom Aluminium man zusammengeben muss.
Vom Gewicht her ist es zunächst einmal schwer die Antwort zu geben, aber wir betrachten zunächst nur die Atome bzw. Moleküle. Und da müssen wir nur zählen, dass kein Atom bei der Reaktion verschwindet oder dazu kommt.
Vorarbeit: Übersetze die systematischen Namen der beteiligten Edukte und Produkte in die Symbolschreibweise und trage es ins Heft ebenfalls untereinander ein:
- Trieisentetraoxid = _________ (besteht also aus ___ Eisenatomen und ___ Sauerstoffatomen)
- (die Formel von Trieisentetraoxid gibt das Atomanzahlverhältnis an, in dem Eisen und Sauerstoff verbunden sind)
- Eisen = ____________
- (Eisen besteht aus einzelnen Atomen)
- Dialuminiumtrioxid = _________ (besteht also aus ___ Aluminiumatomen und ___ Sauerstoffatomen)
- (siehe Trieisentetraoxid! ... nur mit Alumnium und Sauerstoff)
- Aluminium = ____________
- (Aluminium besteht aus einzelnen Atomen)
Da wir nun wissen, aus was die Edukte und Produkte bestehen, können wir schauen, wieviele Atome bzw. Teilchen einer Sorte wir brauchen.
Um dir das Malen und Zählen zu vereinfachen, gibt es ein interaktives Arbeitsblatt. Lies die Anleitung zum Arbeitsblatt, dass auf der externen Seite zu finden ist.
- GeoGebra-Arbeitsblatt Thermitreaktion ausgleichen
Berechne mit Hilfe der Reaktionsgleichung zur Thermitreaktion, wieviel Trieisentetraoxid und wieviel Aluminium man zusammengeben muss, damit man ein stöchiometrisches Gemisch hat.
Bevor du deine Berechnungen unter der Überschrift "Berechnung der benötigten Menge der Edukte" ins Heft einträgst, warte, bis wir es gemeinsam besprochen und die günstigste Schreibweise herausgefunden haben.
Man kann Reaktionsgleichungen zwei Bedeutungen zuweisen:
- Das Ausgleichen von Reaktionsgleichungen hat vor allem dann eine Bedeutung, wenn man sich über Mengen bei einer chemischen Reaktion Gedanken macht. Erst mit einer ausgeglichenen Reaktionsgleichung kennt man die Mengen, die für ein stöchiometrisches Gemisch benötigt werden.
- Dadurch dass man mit der Formel genau weiß, welche Elemente in einer Verbindungen enthalten sind, kann man durchaus auch Vorraussagen machen, welche Produkte bei einer Reaktion herauskommen. Beispiel: Da Butan ein Kohlenwasserstoff mit der Formel C4H10 ist, kann man vorhersagen, dass als Verbrennungsprodukte Kohlendioxid und Wasser als Verbrennungsprodukte entstehen.
Ihr sollt euch als nächstes mit dem Ausgleichen von Reaktionsgleichungen in Symbolschreibweise beschäftigen. Seht das als Vorbereitung für weitere stöchiometrische Berechnungen. Wir werden dies an verschiedenen Stellen gebrauchen.











![Malachit Cu2[(OH)2CO3]](https://upload.wikimedia.org/wikipedia/commons/thumb/f/f9/Malachite_2%28R%C3%A9publique_D%C3%A9mocratique_du_Congo%29.jpg/200px-Malachite_2%28R%C3%A9publique_D%C3%A9mocratique_du_Congo%29.jpg)




