Chemie/Sammlung von Experimenten/Reaktion von Kupfer mit Schwefel: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 51: | Zeile 51: | ||
=== Betrachtung einer chemischen Reaktion === | === Betrachtung einer chemischen Reaktion === | ||
{{AufgabeNr| | {{AufgabeNr|1.1|Beschreibe die Edukte Schwefel und Kupfer möglichst genau und betrachte ihre Eigenschaften. Für Schwefel solltest du dir ein Stück schwefel anschauen, da die pulvrige Form }} | ||
{{AufgabeNr| | {{AufgabeNr|1.2|Halte möglichst genau fest, was bei der Reaktion zu beobachten ist. Dazu gehört auch kurz die Erwähnung der Handgriffe, die du durchführst.}} | ||
{{AufgabeNr| | {{AufgabeNr|1.3|Beschreibe nun die Eigenschaften des entstandenen Produktes, das vorher das Kupferblech war. Vergleiche mit den Eigenschaften von Kupfer und Schwefel. Was ist mit dem ehemals flüssigen Schwefel? Hat er sich auch verändert?}} | ||
{{AufgabeNr| | {{AufgabeNr|1.4|Halte die beobachtete Veränderung in einem Satz fest, indem du aufschreibst, aus welchen Ausgangsstoffen, welche neue Stoffe entstehen.}} | ||
=== Massenbetrachtung für das Gesetz der konstanten Proportionen === | === Massenbetrachtung für das Gesetz der konstanten Proportionen === | ||
{{AufgabeNr| | {{AufgabeNr|2.1|Bestimme vor der Reaktion möglichst genau die Masse des Kupferbleches.}} | ||
{{AufgabeNr| | {{AufgabeNr|2.2|Versuche nach der Reaktion und und Abkühlung des Reagenzglases das Stück Kupfersulfid möglichst vollständig aus dem Reagenzglas zu holen um es wiegen zu können. Notfalls kann das Reagenzglas auch zerstört werden, dann aber nur bei Anwesenheit des Lehrers. | ||
Bleibt ein Stück Kupfersulfid oder haftet am Kupfersulfid noch Schwefel an, sind die Messwerte nicht genau genug.}} | |||
{{AufgabeNr|2.3|Berechne aus der Menge an Kupersulfid und Kupfer die Menge an Schwefel, die mit dem Kupfer reagiert hat und berechne das Verhältnis ''m(Kupfer) : m(Schwefel)'' im Kupfersulfid. Hole dir von Mitschülern ihre Ergebnisse (''wenn sie genau genug sind!'') und sammle sie in einer Tabelle, um einen Überblick zu bekommen. | |||
}} | |||
{{AufgabeNr|2.4|Kannst eine Erklärung für die Beobachtung geben? Vielleicht das Ganze auch zeichnerisch erklären?}} | |||
=== Energiebetrachtung === | === Energiebetrachtung === | ||
{{AufgabeNr| | {{AufgabeNr|3.1| | ||
a.) Ist das eine exotherme oder eine endotherme Reaktion? | |||
b.) Stelle eine Reaktionsgleichung für die Reaktion auf. | |||
c.) Zeichne ein Energiediagramm mit zeitlichem Verlauf ein, benenne die Teilschritte und an welcher Stelle welche Beobachtung aus dem Experiment "stattfindet". | |||
}} | |||
{{AufgabeNr|3.2|Bei der Reaktion von Natrium und Chlor haben wir die einzelnen, dort stattfindenden Teilschritte, angeschaut und deren Energieumsatz festgehalten. Stelle eine ähnliche Überlegung für die Reaktion von Kupfer mit Schwefel an, wobei zu bedenken ist, dass Sauerstoff als Ion entsprechend der Edelgas-Regel geladen ist (''also O<sup>2-</sup>'') und Kupfer sich der Ladung dann anpasst (''hier also Cu<sup>2+</sup>''). | |||
'''Zur Erinnnerung:''' [https://www.tutory.de/w/bed7e5c0 Hier ist das Arbeitsblatt zu Natrium und Chlor!] | |||
}} | |||
== Gefährdungsbeurteilung == | == Gefährdungsbeurteilung == | ||
Zu diesem Experiment existiert eine Gefährdungsbeurteilung. '''[https://zum-wiki.idea-sketch.com/images/b/b7/Gef%C3%A4hrdungsbeurteilung_Synthese_von_Kupfersulfid.odt Download]''' | |||
== Zum Nachschauen == | |||
* [https://www.youtube.com/watch?v=5hNe9w_toh0 Reaktion Kupfer mit Schwefel] | |||
Version vom 16. April 2017, 08:11 Uhr
Sicherheitsinformationen
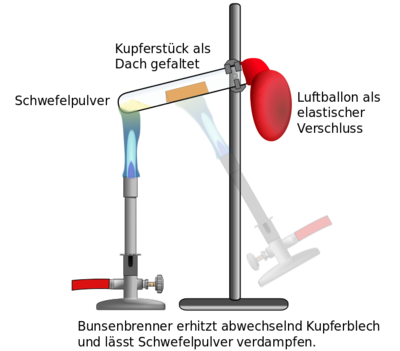
Wie üblich gilt bei der Verwendung des Bunsenbrenners entsprechende Schutzmaßnahmen zu ergreifen, vorsichtig mit dem Bunsenbrenner umzugehen und nicht mit den Flammen allgemein (auch Streichhölzer) zu spielen.
Bei Erhitzen des Schwefels kann durch Verbrennung ein Stoff (Schwefeldioxid) entstehen, der ungesund ist - abgesehen von dem unangenehmen Geruch. Um das zu verhindern und auch, dass wir keinen Schwefeldampf einatmen, wird das Reagenzglas mit einem Luftballon verschlossen.
Für den Fall das das Reagenzglas aufplatzt, etwa weil dauerhaft nur an einer Stelle erhitzt wird, sollte das Stativ mit dem kaputten Reagenzglas umgehend in den Abzug gestellt werden. Dort kann man dann das Reagenzglas entfernen und abkühlen lassen.
Materialien
- Stativstange, Stativfuß, Doppelmuffe, Stativklammer
- Reagenzglas
- Luftballon
- Schwefelpulver
- ein Stückchen Kufperblech, zu einem Dach gefaltet
- Bunsenbrenner und Zündquelle (Streichhölzer, Feuerzeug, Gasanzünder, ...)
- Pinzette
- Holzstab (als Hilfsmittel, um das Kupferblech richtig zu platzieren - nicht immer notwendig)
Durchführung
Teil 1: Durchführung des Experimentes
Entsprechend der Darstellung, wird das Stativ mit dem Reagenzglas vorbereitet. Das Reagenzglas sollte ganz oben am Bördelrand befestigt werden. Es sollte auch nur wenig schräg eingespannt werden, denn wenn es zu schräg ist, rutscht das Kupferblech in den Schwefel, was aber nicht gewünscht ist.
Nachdem Schwefel und Kupferblech richtig platziert sind, wird das Reagenzglas mit dem Luftballon verschlossen. Achtet darauf, das der Luftballon keine sichtbaren Löcher hat und sicher über dem Bördelrand sitzt und dicht abschließt.
Dann kann der Bunsenbrenner angezündet werden.
Zunächst wird das Kupferblech intensiv erhitzt. Achtet auf den richtigen Abstand des Bunsenbrenners zum Reagenzglas, so dass die heißeste Stelle der Flamme auch richtig wirken kann. Stellt den Bunsenbrenner aber nicht einfach unter das Reagenzglas, denn sonst kann damit das Glas durchgeschmolzen werden!
Nach etwa einer Minute kann dann der Schwefel erhitzt werden, bis er gasförmig wird (man sieht die Dämpfe). Sobald die Schwefeldämpfe des Kupferblech erreichen kann man wieder das Kupferblech für kurze Zeit erhitzen. Dann sollten immer abwechselnd Schwefel und Kupfer erhitzt werden, bis man am Kupferblech beobachten kann, dass es zu Glühen anfängt. Dann reicht es, ein wenig den Schwefel zu erhitzen, um genügend Schwefeldampf zum Kupferblech zu "bringen".
Wenn das Glühen einmal durch das Kupferblech "durchgelaufen" ist kann man den Bunsenbrenner abschalten (Reihenfolge beachten!).
Teil 2: Untersuchung des Produktes
Sobald der Schwefel im Reagenzglas wieder eine gelbe Farbe angenommen hat und nicht mehr klar/braun aussieht ist, wird überprüft, ob das Reagenzglas gut genug abgekühlt ist, um sich nicht die Finger daran zu verbrennen.
Dann nehmt ihr den Luftballon ab, legt ihn ggf. im Abzug ab (nicht daran riechen!!) und versucht das feste Produkt, das nun eine andere Farbe als das Kupfer hat, mit der Pinzette heraus zu holen. Wenn noch Schwefel anhaftet, kann der im Abzug mit dem Bunsenbrenner verbrannt werden. Schaut euch das Produkt genauer an und vergleicht es mit dem Kupferblech von vorher. Verwendet auch eine Lupe oder eine Mikroskopkamera, um es genauer zu betrachten.
Entsorgung und Reinigung der Gefäße
Die Entfernung des geschmolzenen Schwefels ist zu umständlich, daher wird das dreckige Reagenzglas zusammen mit dem Luftballon in den Restmüll geworfen werden.
Wer ein Stück Kupfersulfid hat, an dem kein Schwefel anhaftet, kann es mitnehmen und z.B. auch ins Heft mit Tesa einkleben. Sonstige Reste des Kupfersulfids werden ebenfalls über den Restmüll entsorgt.
Auswertung nach der Durchführung des Experiments
ACHTUNG: Da das Experiment für verschiedene Zwecke eingesetzt werden kann, gibt es verschiedene Fragestellungen, die nach dem Experiment bearbeitet werden können.
Betrachtung einer chemischen Reaktion
Massenbetrachtung für das Gesetz der konstanten Proportionen
Versuche nach der Reaktion und und Abkühlung des Reagenzglases das Stück Kupfersulfid möglichst vollständig aus dem Reagenzglas zu holen um es wiegen zu können. Notfalls kann das Reagenzglas auch zerstört werden, dann aber nur bei Anwesenheit des Lehrers.
Bleibt ein Stück Kupfersulfid oder haftet am Kupfersulfid noch Schwefel an, sind die Messwerte nicht genau genug.Energiebetrachtung
a.) Ist das eine exotherme oder eine endotherme Reaktion?
b.) Stelle eine Reaktionsgleichung für die Reaktion auf.
c.) Zeichne ein Energiediagramm mit zeitlichem Verlauf ein, benenne die Teilschritte und an welcher Stelle welche Beobachtung aus dem Experiment "stattfindet".Bei der Reaktion von Natrium und Chlor haben wir die einzelnen, dort stattfindenden Teilschritte, angeschaut und deren Energieumsatz festgehalten. Stelle eine ähnliche Überlegung für die Reaktion von Kupfer mit Schwefel an, wobei zu bedenken ist, dass Sauerstoff als Ion entsprechend der Edelgas-Regel geladen ist (also O2-) und Kupfer sich der Ladung dann anpasst (hier also Cu2+).
Zur Erinnnerung: Hier ist das Arbeitsblatt zu Natrium und Chlor!Gefährdungsbeurteilung
Zu diesem Experiment existiert eine Gefährdungsbeurteilung. Download