Benutzer:BirgitLachner/Chemie-Buch I zum Lehrplan in Rheinland-Pfalz/Vom Erdöl zu Seife und Tensiden/Isomerie bei Alkanen: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
Keine Bearbeitungszusammenfassung Markierung: 2017-Quelltext-Bearbeitung |
||
| Zeile 6: | Zeile 6: | ||
: '''''WICHTIG:''' Es gibt kein einzelnes Isomer!''|3=Hervorhebung2}} | : '''''WICHTIG:''' Es gibt kein einzelnes Isomer!''|3=Hervorhebung2}} | ||
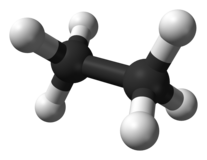
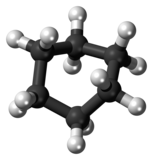
Betrachten wir dazu zwei Moleküle, mit jeweils vier Kohlenstoffe-Atomen, beide in verschiedenen Darstellungen: | |||
<gallery widths=250px heights=160px style="text-align:center"> | |||
File:1 Butan.svg|Die erste Variante hat eine Kette von vier Kohlenstoffatomen, die hintereinander angeordnet sind, ... | |||
File:1-Buthane.png|... hier als Kugelstab-Modell. Die Kohlenstoffkette ist aufgrund der tetratedrischen Anordnung der vier Bindungspartner tatsächlich gewinkelt. | |||
</gallery> | |||
<gallery widths=250px heights=160px style="text-align:center"> | |||
File:Butane-negative-gauche-side-3D-balls.png | |||
File:Butane-3D-balls.png | |||
</gallery> | |||
Version vom 29. Oktober 2018, 20:04 Uhr
Wiederholen wir gerade noch einmal den Begriff, den wir auf der vorherigen Seite schon eingeführt haben.
Als Isomerie bezeichnet man die Existenz von zwei oder mehreren chemischen Verbindungen mit gleicher Summenformel, die sich jedoch in der Verknüpfung oder der räumlichen Anordnung der Atome unterscheiden. Die entsprechenden Verbindungen werden Isomere genannt und lassen sich durch unterschiedliche Strukturformeln darstellen.
- WICHTIG: Es gibt kein einzelnes Isomer!
Betrachten wir dazu zwei Moleküle, mit jeweils vier Kohlenstoffe-Atomen, beide in verschiedenen Darstellungen:
Hast du die Begriffe verstanden? Dann schau versuche mal zu begründen, warum wir bei den folgenden zwei Molekülen sagen können, dass sie keine Isomere sind.
Warum sind diese beiden Moleküle keine Isomere?