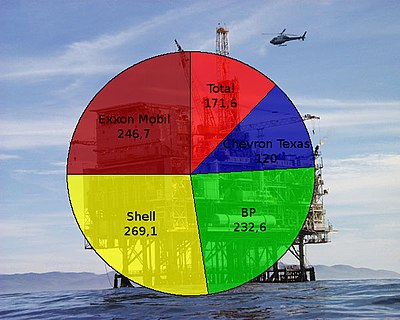
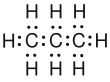Oberstufen-Chemiebuch Kontextorientiert/Erdöl - immer noch der wichtigste Energieträger
Erdöl: was ist es und woher kommt es
Erdöl ist zunächst einmal ein Gemisch aus verschiedenen Kohlenwasserstoffen. Jedes Erdöl hat je nach Fundort eine spezielle chemische Zusammensetzung, die auch die physikalischen Eigenschaften wie die Farbe und die Viskosität bestimmt. Erdöl enthält in geringerem Maße auch verschiedene organische Verbindungen, die Stickstoff, Sauerstoff oder Schwefel enthalten. Daneben finden sich auch Verbindungen von Metallen wie Eisen, Kupfer, Vanadium und Nickel.
Der Anteil der reinen Kohlenwasserstoffe variiert erheblich. Der Anteil reicht von 97 % bis zu nur 50 % bei Schwerölen und Bitumen.
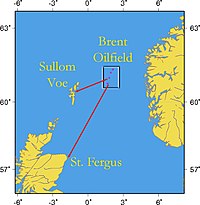
Typische Rohöle unterscheiden sich nach der Lagerstätte. Diesen Öltypen gibt man spezielle Namen, durch die man auch die Qualität der Ölsorten schnell beschreiben kann. Am bekanntesten dürfte die Ölsorte Brent sein, die ein Gemisch der Rohölen aus den 15 Ölfeldern des sogenannten Brentsystems in der Nordsee ist. Außerdem gibt es zum Beispiel noch das West Texas Intermediate (WTI), das ein qualitativ hochwertiges, schwefelarmes und leichtes Rohöl aus Cushing (Oklahoma) ist. Das Dubai-Oman aus dem Mittleren Osten wird vor allem für den asiatisch-pazifischen Markt gefördert. Das Tapis aus Malaysia ist ein leichtes, das Minas aus Indonesien ein schweres fernöstliches Rohöl.
Schwefelarmes Rohöl wird „süß“ genannt (engl. sweet crude oil, u. a. die Sorte Brent), schwefelreiches „sauer“ (engl. sour crude oil). Der Grund für die Benennung ist der im Rohöl enthaltene Schwefel, der durch Verbrennung zum Gas Schwefeldioxid (SO2) der Hauptverursacher des sogenannter Saurer Regen ist.
- Wie Erdöl und Erdgas entsteht.
- Woher der Unterschied zwischen Erdöl und Erdgas
- Wo findet man aktuell Erdöl/Erdgas
- Erdölförderung

Erdölverarbeitung
Das Video liefert die erste Informationen rund um die Verarbeitung des Erdöls.
Bestandteile des Erdöls
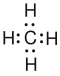
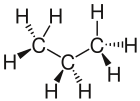
Für die Alkane und andere Kohlenwasserstoffe gibt es, wie in der Lösung zu sehen ist, mehrere Möglichkeiten ihre Struktur darzustellen. Anhand von einigen Beispiel, auch von den Nicht-Kohlenwasserstoffen, sollen diese noch einmal vorgestellt werden:
Erläuterungen zu den Schreibweisen:
- Die Elektronenformel und die Lewissschreibweise sind verschiedenen Varianten der gleichen Darstellung des Moleküls. Hier sind die Elektronen der Valenzschale (der äußersten Schale) dargestellt. Bei der Elektronformel wird eine Elektronenpaar als zwei Punkte dargestellt, während man bei der Lewisschreibweise dafür einen Strich verwendet. Zur Darstellung gehören auch die freien Elektronenpaare, da sie für die tatsächlichen Winkel wichtig sind. Meist werden die Bindungen am C-Kohlenstoff-Atom im rechten Winkel dargestellt, auch wenn der Winkel tatsächlich ein anderer ist.
- Bei der Lewisschreibweise kann man sich auch Schreibarbeit ersparen, indem man die H weglässt und nur die Bindung, die zum H hinführt aufschreibt. Dabei müssen aber alle Bindungen gezeichnet werden. Diese Vorgehensweise ist nur hier möglich!
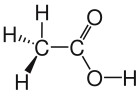
- Die Keilstrichschreibweise ist dafür gedacht, die Lewisschreibweise genauer zu machen, indem man versucht die Darstellung in 3D darzustellen. Um dies zu erreichen, wird davon ausgegangen, dass die C-Atome der längsten Kohlenstoff-Kette in der Blatt-Ebene liegen. Dabei wird auch auf die richtigen Bindungswinkel geachtet. Für Bindungen bei denen beide Atome in dieser Blattebene liegen verwendet man normale Striche. Ragt zum Beispiel ein Wasserstoff-Atom ragt aus der Zeichenebene heraus so zeichnet man eine keilförmig fett gezeichnete Bindung
 . Befindet sich das Wasserstoff-Atom hinter der Zeichenebene so verwendet man eine gestrichelt gezeichnete, keilförmige Bindung
. Befindet sich das Wasserstoff-Atom hinter der Zeichenebene so verwendet man eine gestrichelt gezeichnete, keilförmige Bindung  .
. - Die Skelettschreibweise ist eine sehr schnelle Schreibweise. Bei den Strichen geht man davon aus, dass an jedem Ende eines Striches ein C-Atom zu finden ist. Von den H-Atomen sind immer genau so viel vorhanden, wie benötigt werden, damit der Kohlenstoff alle Bindungen belegt hat. Andere Atome als die Kohlenstoffatome werden immer mit ihrem Symbol angegeben und auch sie sitzen an den Enden der Striche. Man muss beachten, dass hier ein Strich, der zum Beispiel von einer Kette abzweigt, nicht wie bei der verkürzten Lewisschreibweise einem H entspricht sondern einer Gruppe CH3.
- Die Skelettschreibweise wird häufig mit der Keilschreibweise kombiniert. Dann zählt ein Keil wie ein Strich.
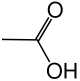
- Bei der Halbstrukturschreibweise werden Gruppen zusammengefasst. So sind bei den Kohlenwasserstoffen in der Mitte der Kette lauter CH2-Gruppen, am Ende immer eine CH3-Gruppe. Hat man eine spezielle Gruppierung, wie bei der Essigsäure, so wird gibt es übliche Schreibweisen für spezielle Gruppen, hier COOH.
- Die Summenformel zählt die vorhandenen Atome auf und mit Index ergänzt man, wie viele von jedem Atom vorkommen. Dabei wird aber nicht auf spezielle Gruppierungen Rücksicht genommen. Das ist meist auch nicht so gut, weil es mit gleicher Summeformel verschiedene Strukturformeln gibt.
- Die Verhältnisformel ist für Organische Moleküle nicht sinnvoll, denn sie ist eine Art gekürzte Summenformel ist. Bei Molekülen muss man aber genau wissen, wieviele Atom darin enthalten sind. Bei Formeln von Ionenverbindungen handelt es sich immer Verhältnisformeln, denn man hat ja kein Molekül mit einer bestimmten Anzahl an Atomen hat. NaCl bedeutet, dass Natrium- und Chloridionen im Verhältnis 1:1 vorkommen.
Erster Teil der Verarbeitung: die Destillation
a.) Halte die Fraktionen einer typischen Eröl-Destillations-Anlage fest und halte dessen Siedebereich fest.
b.) Informiere dich über typische Vertreter der entsprechenden Fraktionen, möglichst aus den verschiedenen Gruppen der Kohlenwasserstoffe. Sucht die Strukturformeln und die Siedetemperaturen heraus.
c.) Erkläre, woher die Unterschiede bei den Siedetemperaturen kommen.
ACHTUNG: Konzentriert euch auf die Bestandteile, die Film vorkommen. Es soll nicht für einen Vortrag recherchiert werden!Benennung der Alkane
Grundlage für alle Benennungen ist die sogenannten homologe Reihe der Alkane. Dabei handelt es sich um lineare, gesättigte Kohlenstoffe. Die ersten haben spezielle Namen, die folgenden haben systematische Namen, die man aber auch lernen muss.
| C | Name | Summenformel | Siedepunkt | Kugel-Stab-Modell |
|---|---|---|---|---|
| 1 | Methan | CH4 | 111,4 K | |
| 2 | Ethan | C2H6 | 185 K | |
| 3 | Propan | C3H8 | 231 K | |
| 4 | n-Butan | C4H10 | 272,5 K | |
| 5 | n-Pentan | C5H12 | 309 K | |
| 6 | n-Hexan | C6H14 | 342 K | |
| 7 | n-Heptan | C7H16 | 371 K | |
| 8 | n-Octan | C8H18 | 399 K | |
| 9 | n-Nonan | C9H20 | 424 K | |
| 10 | n-Decan | C10H22 | 447 K | |
| 11 | n-Undecan | C11H24 | 469 K | |
| 12 | n-Dodecan | C12H26 | 489 K |
Weiterverarbeitung der Erdölfraktionen
- Welche Bestandteile werden benötigt.
- Zweiter Teil: Weiterverarbeitung