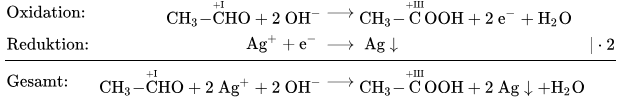Chemie-Lexikon/Redoxreaktionen mit Elektronenübertragung: Unterschied zwischen den Versionen
Markierung: Quelltext-Bearbeitung 2017 |
Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 360: | Zeile 360: | ||
Zur Überprüfung können alle ermittelten Oxidationszahlen addiert werden. Ihre Summe muss insgesamt Null ergeben, wenn das Gesamtmolekül ungeladen ist - wie es vorher auch schon war. | Zur Überprüfung können alle ermittelten Oxidationszahlen addiert werden. Ihre Summe muss insgesamt Null ergeben, wenn das Gesamtmolekül ungeladen ist - wie es vorher auch schon war. | ||
{{Box|AUFGABE | {{Box|AUFGABE 12 - Bestimmung der Oxidationszahlen bei kleinen Molekülen|2= | ||
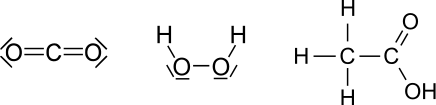
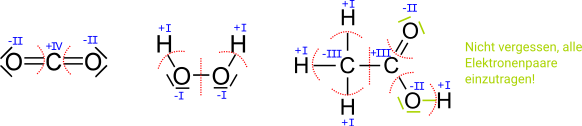
Bestimme von den folgenden kleinen Molekülen alle Oxidationszahlen. '''ACHTUNG:''' Es gibt eine Falle! | Bestimme von den folgenden kleinen Molekülen alle Oxidationszahlen. '''ACHTUNG:''' Es gibt eine Falle! | ||
<center>[[Datei:AUFGABENBILD Oxidationszahlen 1.svg]]</center> | <center>[[Datei:AUFGABENBILD Oxidationszahlen 1.svg]]</center> | ||
Version vom 19. Januar 2019, 19:43 Uhr
In der Mittelstufe werden die Begriffe Reduktion und Oxidation meist im Zusammenhang mit Verfahren zur Gewinnung von Metallen besprochen, wobei eine Übertragung von Sauerstoff stattfindet.
Wiederholung: Redoxreaktionen als Sauerstoffübertragungsreaktionen
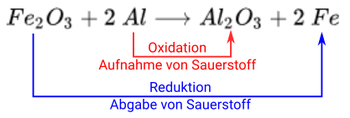
In der Mittelstufe kommen Redoxreaktionen im Rahmen der Verfahren zur Gewinnung von Metallen zur Sprache. Typischerweise betrachtet man die Reduktion von Kupfererzen mit Hilfe von Kohle und den Hochofen-Prozess. Aber auch bei der Thermitreaktion handelt es sich um ein Redoxreaktion:
Hier findet zum einen die Oxidation von Aluminium statt, hin zu . Zum anderen die Reduktion von hin zu Eisen.
Beide Teil-Reaktionen haben eine Funktion in der Gesamtreaktion.
- Die Oxidation von Aluminium liefert die für die Reduktion benötigte Energie, denn Oxidationen sind immer exotherm und Reduktionen endotherm. Aluminium ist daher auch das Reduktionsmittel.
- Die Reduktion von führt zur Freisetzung von Sauerstoff, was die Oxidation begünstigt und damit verstärkt. wirkt damit als Oxidationsmittel.
Noch einmal kompakt die Begriffe zusammengefasst:
- Oxidation = Reaktion mit Aufnahme von Sauerstoff
- Reduktion = Reaktion mit Abgabe von Sauerstoff
- Oxidationsmittel = Stoff, der die Oxidation ermöglicht, indem er selber Reduziert wird.
- Reduktionsmittel = Stoff, der die Reduktion ermöglicht, indem er selber oxiddiert.
Redoxreaktionen ohne Sauerstoff
Betrachtet man Reaktionen an denen kein Sauerstoff beteiligt ist, dann kann man Gemeinsamkeiten zu den Reaktionen mit Sauerstoff erkennen.
Beispiel:
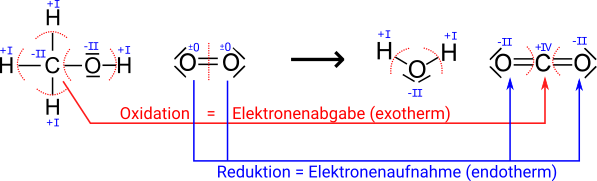
In beiden Reaktionen geben die Kupferatome Elektronen ab und es entstehen
Das heißt, in beiden Beispiel reagiert das Kupfer genauso: es gibt sowohl bei der Reaktion mit Sauerstoff Elektronen ab, also auch bei der Reaktion von Kupfer mit Schwefel. Daher macht es Sinn, die Oxidation bzw. Reduktion in Zusammenhang mit der Übertragung von Elektronen zu betrachten.
Geschichtliches und Verallgemeinerung
Der Begriff Oxidation wurde ursprünglich von dem französischen Chemiker Antoine Laurent de Lavoisier geprägt, der damit die Reaktionen von Elementen und chemischen Verbindungen mit dem Element Sauerstoff (Oxygenium, franz: oxygène) und dessen Aufnahme, unter Bildung von Oxiden, beschreiben wollte. Als Lavoisier die Theorie in den 1780er Jahren veröffentlichte, hatte er anfänglich gegen die Anhänger der Phlogiston-Theorie zu kämpfen, konnte sich aber durchsetzen.
Später erfolgte eine Erweiterung des Begriffes, indem man Reaktionen mit einbezog, bei denen einer Verbindung Wasserstoffatome entzogen wurden (Dehydrierung). Auf Grundlage der Ionentheorie und des Bohrschen Atommodells konnte die Oxidation schließlich unter Betrachtung der Aufnahme und Abgabe von Elektronen interpretiert und verallgemeinert werden.
Daher werden heute die Begriffe zu den Redoxreaktionen mit Hilfe der Aufnahme und Abgabe von Elektronen definiert.
- Oxidation = Elektronenabgabe
- Reduktion = Elektronenaufnahme
- Reduktionsmittel = Stoff, der beim Reaktionspartner die Reduktion bewirkt, indem er ihm Elektronen abgibt
- Oxidationsmittel = Stoff, der beim Reaktionspartner die Oxidation bewirkt, indem er ihm Elektronen abnimmt
Beispiele:
- ... da die Eisen-Atome Elektronen abgeben, findet eine Oxidation statt.
- ... hier muss man etwas genauer überlegen. Die Ladung 4+ bedeutet, dass bei diesem Ion vier Elektronen fehlen im Vergleich zu einem neutralen Atom. Und bei der der Ladung 2+ fehlen "nur noch" 2 Elektronen. Also sind zwei Elektronen dazugekommen. Darum ist es eine Reduktion.
- ... hier könnte man noch klären, welche Ladung Blei in der Verbindungen und jeweils hat. Allerdings ist die "alte" Definition bezüglich der Oxidation bei Sauerstoff-Aufnahme immer noch gültig. Daher findet hier auch eine Oxidation statt.
- ... da die Chloratome hier Elekronen aufnehmen, findet eine Reduktion statt.
Schon bei diesen Beispiel zeigt sich, dass man sicher in der Bestimmung einer Ladung sein muss und was die Ladung bei einem Ion bedeutet. Damit man also erkennen kann, ob Elektronen aufgenommen werden oder abgegeben werden. Wenn Sauerstoff beteiligt ist, so können wir eigentlich immer diesen auch mit betrachten und können uns allgemein merken.
- Oxidation = Sauerstoffaufnahme oder Elektronenabgabe
- Reduktion = Sauerstoffabgabe oder Elektronenaufnahme
- Reduktionsmittel = Stoff, der beim Reaktionspartner die Reduktion bewirkt, indem er ihm Elektronen abgibt.
- Oxidationsmittel = Stoff, der beim Reaktionspartner die Oxidation bewirkt, indem er ihm Elektronen abnimmt.
Als kleine Ergänzung noch ein Begriff, der später noch einmal wichtig sein wird.
Unter einem Redoxpaar versteht man ein Paar von Teilchen, die durch Auf- bzw. Abnahme von Elektronen ineinander überführt werden können. Zum Beispiel:
- und
Oxidation/Reduktion erkennen
Eine grundlegende Aufgabe ist die Bestimmung der Ladung von Ionen der Hauptgruppenelemente. Weil diese Aufgabe so grundlegend ist und sie häufig besprochen wurde, werden die folgenden Aufgaben für einige etwas einfach sein, aber Übung schadet trotzdem ist, oder? Das PSE (⇒ Download PSE) ist hier ein wichtiges Hilfsmittel! Hier noch mal die wichtigsten Infos dazu:
Folgende Regeln sollte man beachten:
- Die Atome der Hauptgruppen-Elemente versuchen den Edelgaszustand (meist 8 Außenelektronen) zu erreichen, indem sie Elektronen aufnehmen oder abgeben. Beispiel: Na erreicht die Ne-Elektronenkonfiguration und P erreicht Elektronenkonfiguration von Ar. Die Ausnahme ist das Helium mit zwei Außenelektronen
- Da der Edelgaszustand immer durch Abgabe oder Aufnahme erreicht werden kann, wird es meist so sein, das so wenig wie möglich Elektronen aufgenommen oder abgegeben werden.
- Also statt .
- Die Gesamtanzahl an aufgenommenen oder abgegebenen Elektronen soll so klein wie möglich sein, wenn man eine Ionen-Verbindung betrachtet.
- In Ionenverbindungen haben Metalle meist eine positive Ladung, die Nichtmetalle haben meist eine negative Ladung und die Halbmetalle haben je nach Partner eine positive oder negative Ladung.
- Diese Regel kann aber nicht für Moleküle verwendet werden, dabei wird die Oxidationszahl mit eigenen Regeln bestimmt!
Oxidationszahl
Um festzustellen, ob eine Oxidation oder eine Reduktion bei einem Redoxpaar stattfindet haben wir bisher immer die Ladungen der Ionen betrachtet. Das ist bei zusammengesetzen Ionen, wie oder nicht möglich, da das geladene Teilchen ein zusammenhängendes Molekül ist.
Man nutzt dann die Oxidationszahl (manchmal auch Oxidationsstufe, Oxidationswert, elektrochemische Wertigkeit), die die theoretische Ionenladung eines Atoms innerhalb einer chemischen Verbindung oder eines mehratomigen Ions angibt. Dabei geht man davon aus, dass das zusammengesetzte Molekül in Ionen zerlegt wird. Anders als bei den tatsächlichen Ionenladungen, die als Zahl mit nachgestelltem oder geschrieben werden, wird bei Oxidationszahlen das + oder − als Vorzeichen vorangestellt und die Zahl mit römischen Ziffern angegeben. Im Falle der Oxidationszahl Null wird teilweise ±0 geschrieben.
Die Oxidationszahl ist eine gedachte Ladung eines Atoms innerhalb einer chemischen Verbindung oder eines mehratomigen Ions. Eine wesentliche Rolle spielt dabei die Elektronegativität, bei anorganischen Verbindungen kann man sich auf einige Regeln zur Bestimmung konzentrieren.
- Beispiel für die Schreibweise:
HINWEIS: Bei Metallverbindungen kommen die römischen Ziffern für die Oxidationsstufen auch teilweise im Namen vor. Bei Eisen(II)oxid geht es um ein Eisenoxid, bei dem Eisen die Oxidationsstufe +II hat. Das Vorzeichen kann man bei Metallen auch deshalb weglassen, da Metall-Ionen immer eine positive Ladung bzw. Oxidationsstufe haben.
Bei den einzelnen Ionen, vor allem den Hauptgruppen-Elementen, nutzen wir die Hauptgruppennummer, um die Ladung der Metall-Ionen zu bestimmen. Dabei wird die Edelgasregel benutzt. Diese Edelgasregel ist zwar wichtig und richtig, aber sie gilt gerade bei Elementen ab der 3. Periode nicht mehr so streng. Das liegt vor allem daran, dass ab der 3. Schale Platz für mehr als 8 Elektronen ist.
Wie schon erwähnt, spielt die Elektronegativität ein Rolle. Allerdings werden wir, statt immer ins PSE gucken zu müssen, einige Regeln festhalten, mit denen man auch ohne die Elektronegativität entscheiden kann, wie die Oxidationszahl eines Atoms in der Verbindung ist. Hinter diesen Regeln steht aber die Elektronegativität, denn in einer Verbindung werden bindende Elektronenpaare gedanklich dem elektronegativeren Bindungspartner zugewiesen (Fachbegriff: heterolytische Spaltung).
| Nr. | Regel | Erklärung | Beispiele |
|---|---|---|---|
| 1 | Atome im elementaren Zustand haben immer die Oxidationszahl ±0 Ausnahme: Ozon (O3) ist eine spezielle Variante von Sauerstoff. Man müsste die Struktur betrachten! | Die Atome haben die Elektronenanzahl, die zum Kern passt, also ist die Ladung 0 | I2, C, O2, P4, S8 |
| 2 | Bei einatomigen Ionen entspricht die Oxidationszahl der Ionenladung | wie bisher | Cu2+ hat die Oxidationszahl +II, Ag+ hat die Oxidationszahl +I |
| 3 | Die Summe aller Oxidationszahlen in einer Verbindung/einem Molekül entspricht der Ladung | Die Gesamt-Ladung (e- und p+) muss stimmen. Das kann bei einer neutralen Verbindung zusammen Null sein, bei einem geladenen Molekül ist es dessen Ladung. | CH4 → C -IV und H je +I also -4 + 4*(+1) = 0 SO42- → S + VI und O -II also +6 + 4*(-2) = -2 |
| 4 | Fluor hat in Verbindungen immer die Oxidationszahl −I | Wegen der höchsten Elektronegativität | KF, HF, ... |
| 5 | Sauerstoff hat meist die Oxidationszahl −2 Ausnahmen: In Peroxiden (mit -O-O-) und in Verbindungen mit Fluor. |
Die Fluor-Regel hat eine höhere Priorität! | H2O2 → O -I und H +I, OF2 → O +II und F -I |
| 6 | Weitere Halogenatome (Cl, Br, I) haben meist die Oxidationszahl −I Ausnahmen: In Verbindungen mit Fluor, Sauerstoff und einem anderen Halogen mit höherem EN-Wert |
Die vorherigen Regeln haben Vorrang und wegen der Defintion der Elektronegativität | ClO2 → Cl +IV und O -II BrCl → Br +I und Cl -I |
| 7 | Metallatome haben in Verbindungen immer eine positive Oxidationszahl Ausnahme: Halbmetalle können sich auch wie Nichtmetalle verhalten. |
Metalle geben Elektronen leicht ab. | Na+, Hg2+, Al3+, Si4+, As5+, ... aber: Natriumarsenid Na3As → Na +I und As -III |
| 8 | Alkalimetalle haben als Oxidationszahl +I und Erdalkalimetalle +II | Ergibt sich aus der Edelgasregel. | Beispiel |
| 9 | Wasserstoffatome bekommen die Oxidationszahl +I Ausnahmen: Wenn Wasserstoff mit „elektropositiveren“ Atomen wie Metallen oder sich selbst direkt verbunden ist. |
Wegen der Defintion der Elektronegativität. | H2O → H +I und O -II und HCl → H +I und Cl -I aber: Natriumhydrid NaH → Na +I und H -I |
An zwei Beispielen soll die Anwendung der Regeln und die sich daraus ergebende Folgerung für Atomsorten, die nicht in der Tabelle festgelegt sind.
Beispiel 1: Bestimmung der Oxidationszahl von Phosphor in der Phosphorsäure
Aufgrund der Regeln, die in der Tabelle vorgegeben sind, wissen wir die Oxidationszahlen von Sauerstoff (-II) und Wasserstoff (+I). Weiterhin wissen wir, dass das gesamte Molekül neutral geladen ist, weil keine Ladung angegeben ist.
Aufgrund der Anzahl der Atome im Molekül müsste also gelten:. Daraus ergibt sich
Beispiel 2: Bestimmung der Oxidationszahl von Stickstoff im Dithionat-Ion .
Aufgrund der Regeln, die in der Tabelle vorgegeben sind, wissen wir die Oxidationszahlen von Sauerstoff (-II). Das Dithionat ist ein Ion und hat die Ladung -2
Aufgrund der Anzahl der Atome im Molekül müsste also gelten:. Daraus ergibt sich
Nachdem nun die wichtigsten Regeln vorgestellt wurden, folgt eine größere Anzahl an Übungen rund um die Bestimmung der Oxidationszahl. Es fängt mit einfachen Übung zur Bestimmung der Oxidationszahl an einzelnen Verbindungen an und geht es zu Übungen, wo es darum geht einen Änderung der Oxidationszahl richtig zu interpretieren, um erkennen zu können, ob und wo eine Oxidation oder eine Reduktion stattfindet.
Ein kleiner Tipp noch, der praktisch und gut zu merken ist ...
Übungen zur Bestimmung von Oxidationszahlen in anorganischen Verbindungen
Hier gibt es zum Austoben ein paar Aufgaben ... Bestimmt die Oxidationszahlen in den folgenden Verbindungen:
- H2O, MgO, Al2O3, NaCl, N2, NaOH, NH3, SO2, CaO, H2S, SO3, K2O, Na2CO3 , N2O3 , BaO2 , Cl2O4, K2SnO3, H2N2O2, CaB2O4, Cr2O42-, Cr2O72-, AsO43-, MnO4-, HOBr, HBrO2, HBrO3, HBrO4, SCl2, PCl3, BCl3, SnH4, SbCl5, SeF6
Chlor bildet verschiedene Sauerstoffsäuren. Da gibt es: Hypochlorige Säure HClO ("Unterchlorige Säure"), Chlorige Säure HClO2, Chlorsäure HClO3 und Perchlorsäure HClO4.
- 8.1 Gib die Oxidationszahl des Chlors in den verschiedenen Säuren an.
- Hypochlorige Säure
- Chlorige Säure
- Chlorsäure
- Perchlorsäure
- 8.2 Überlege, warum es keine Säure mit der Oxidationszahl +IX gibt ("Chlor(IX)–Säure") oder keine mit der Oxidationszahl +IV gibt?
Zum ersten Teil: die Oxidationszahl +IX würde bedeuten, dass Chlor 9 Elektronen abgegeben hätte im Vergleich zur normalen Elektronenanzahl. Bei +VII, also 7 Elektronen weniger, hat Chlor den Edelgaszustand (wie Neon), weil die dritte Schale dann keine Elektronen mehr hat. Das würde bedeuten, dass das Atom noch kleiner würde, bei starker Ladung. Das Bedürfnis von diesem Chlor(+IX) wieder Elektronen aufnehmen zu wollen, wäre dann extrem groß und es würde sich die Elektronen von anderen Atomen holen.
Zum zweiten Teil der Frage: Bei den Beispielen von den existierenden Chlorsäuren fällt auf, dass der Unterschied in den Oxidationsstufen immer 2 ist. Das das Chlor sozusagen immer zwei Elektronen weniger hat, kommt daher, dass immer ein Sauerstoff-Atom dazu kommt, dass dem Chlor die zwei Elektronen wegnimmt. In diesem Prinzip der Chlorsäuren wäre das dann nicht mehr möglich. Denkbar wäre höchstens, dass zwei Chloratome direkt miteinander verbunden sind. Da gibt es keinerlei Verbindung, in denen das der Fall ist, wo zwei Atome miteinander verbunden sind und gleichzeitig andere Atome im Molekül enthalten sind.
Abschließend zu den ersten Übungen zu den Oxidationsstufen ist ein Blick nach "draußen" vielleicht einmal interessant.
- Wikipedia liefert ein Liste aller möglichen Oxidationszahlen

- In einem Artikel der Zeitschrift "Nature", wird von dem Element mit der bisher höchsten Oxidationsstufe +IX berichtet.
Übungen zur Bestimmung von Oxidationszahlen um Redoxreaktionen zu erkennen
Hier ein paar einfache Reaktionen, die als Gleichungen gegeben sind.
AUFGABE: Bestimme bei den beteiligten Verbindungen die Oxidationsstufen und ob es sich dabei jeweils um eine Redoxreaktion handelt. Gib auch an, wo die Reduktion und wo die Oxidation stattfindet und wieviele Elektronen aufgenommen und abgegeben werden.
Bei der letzten Aufgabe haben wir einen speziellen Fall, nämlich, dass eines der Edukte sowohl reduziert, als auch oxidiert wird. Dafür gibt es einen Begriff und wir ergänzen einen zweiten Begriffe, die man kennen sollte/könnte, wobei bei Kenntnis von ausreichend Fremdwörtern eine Übersetzung einfach ist.
Reaktionen, bei denen aus zwei unterschiedlichen Oxidationszahlen (Stickstoff: +2 und +5) eine mittlere Oxidationszahl (Stickstoff: +4) entsteht, nennt man Symproportionierung.
Es ist erkennbar, dass ein -Molekül durch eine Oxidation und zwei -Moleküle durch Reduktion entstanden sind.
Der gegenteilige Fall heißt Disproportionierung. Dabei entstehen aus einer mittleren Oxidationszahl zwei extremere Oxidationszahlen. Im folgenden Beispiel oxidieren drei der vier H3PO3-Moleküle zu Phosphorsäure und eins reduziert zu Phosphorwasserstoff:
Die dabei ablaufende Reaktion kann sowohl nach rechts ablaufen (Strom wird geliefert = Entladen) oder nach links (Akku wird geladen).
AUFGABE: Bestimme alle Oxidationsstufen für das Entladen und bestimme, wo die Oxidation und wo die Reduktion stattfindet.
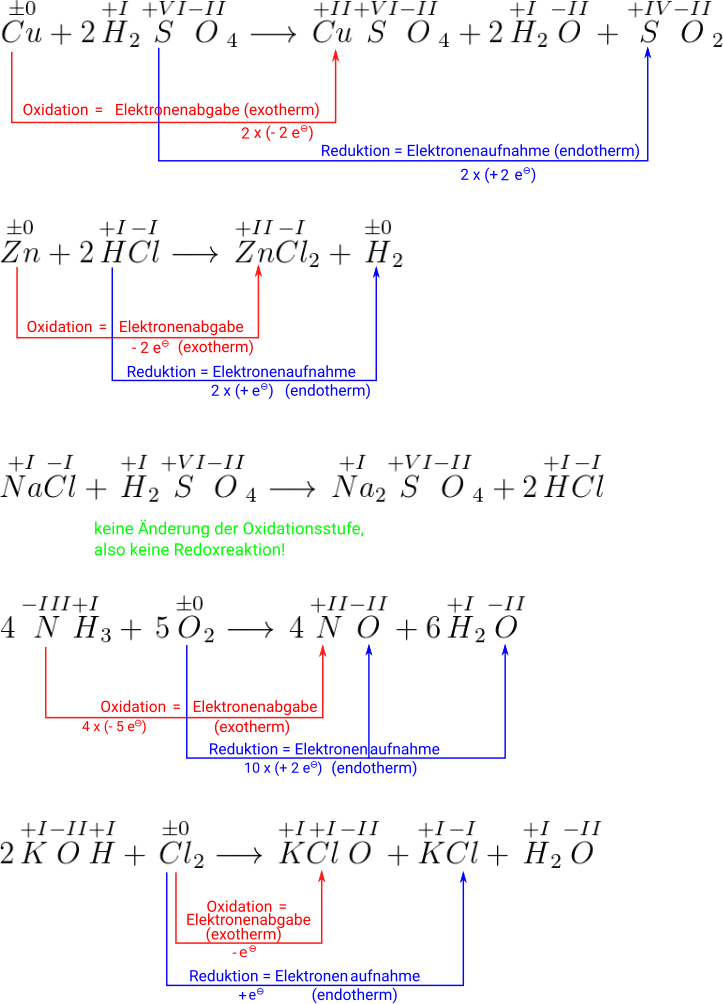
Man sieht, dass sich die Oxidationsstufe nur beim Blei ändert. Das elementare Blei () gibt zwei Elektronen hab und oxidiert deshalb zu . Das Blei im mit der Oxidationszahl +IV nimmt zwei Elektronen auf und reduziert zu .
Bei Redoxreaktionen betrachtet man ja immer die Reduktion und die Oxidation getrennt, indem man die Teilreaktionen über Pfeile darunter oder auch darüber markiert. Gerne schreibt man statt einer Gesamt-Reaktion auch die Teilreaktionen auf, für Oxidation und Reduktion eine eigene Reaktion, wobei Elektronen als Edukte und Produkte auftauchen.
Ein Beispiel: Eisen(III)-Ionen reagieren mit Iodid-Ionen zu Eisen(II)-Ionen und Iod.
Lösungsschritte:
- Reaktionsgleichung ausgleichen:
- Reaktionsgleichung mit Oxidationzahlen (bei Einzel-Ionen ist die Ladung gleich der Oxidationsstufe):
- Zusammengehöriges Paar bei Edukten und Produkten (Redoxpaar) erkennen, wo die Oxidation stattfindet, wo also Elektronen abgegeben werden.
- Oxidation:
- Zur Erklärung: Als hat das Iodid-Ion ein Elektron mehr als das neutrale Atom. Wenn es dann zum neutralen Iod (auch wenn es als Molekül vorliegt) reagiert, hat es das überschüssige Elektron abgegeben. Und daher tauchen Elektronen als Produkt auf.
- Zusammengehöriges Paar bei Edukten und Produkten (Redoxpaar) erkennen, wo die Reduktion stattfindet, wo also Elektronen aufgenommen werden.
- Reduktion:
- Zur Erklärung: Als fehlen diesem Eisen-Ion drei Elektronen im Vergleich zum neutralen Eisen-Atom. Es reagiert zu , also fehlen nur noch zwei Elektronen. Das heißt im Vergleich zu vorher, ist ein Elektronen dazu gekommen. Daher wird das Elektron als Edukt dazu gegeben.
Übrigens ... man erkennt natürlich sehr schnell, welche Teilchen zusammen gehören, welche also ein Redoxpaar bilden. Erst wenn man nach den Oxidationszahlen geschaut hat, kann man entscheiden, ob bei einem Paar die Oxidation oder die Reduktion stattfindet. Daher kann man das auch nachträglich davor schreiben.
Hier ein paar einfache Redoxreaktionen, die schon ausgeglichen sind.
AUFGABE: Bestimme bei den beteiligten Verbindungen die Oxidationsstufen. Schreibe dann die Teilreaktionen für die Oxidation und die Reduktion getrennt auf und ergänze die notwendigen Elektronen.
Der umgekehrte Aufgabenstellung kann auch vorkommen. Man hat die Teilreaktionen und bestimmt aus Ihnen die Gesamt-Reaktion.
Dies ist bei vielen Redoxreaktionen der Fall. Vor allem bei Reaktionen, die in der Analyse verwendet werden, kommen neben dem Redoxpaar noch weitere Verbindungen vor. Oft gibt es Redoxpaare, bei denen Sauerstoff-Atome als Ionen aufgenommen oder abgegeben werden, wobei diese dann Teil von Wasser sind. Oft hat man auch Reaktionen, die im sauren oder alkalischen Milieu stattfinden. Dann reagieren im sauren bzw. -Ionen mit, im alkalischen Milieu sind es -Ionen.
Das Problem ist dabei, dass so viele Teilchen beteiligt sind, dass ein Ausgleichen nicht so einfach ist. Zumal der wichtigste Aspekt die Anzahl der abgegebenen bzw. aufgenommenen Elektronen ist und ein einfacher Ausgleich nach den Elementen beachtet dies nicht.
Das Aufstellen von Redoxgleichungen mit Sauerstoffbeteiligung, im sauren oder alkalischen Milieu, wird auf einer extra Seite ausführlich erklärt.
→ Redoxgleichungen aufstellenOxidationszahl bei Organischen Verbindungen
Komplizierter ist die Bestimmung der Oxidationszahlen bei Verbindungen, wenn sie organische Verbindungen sind. Kohlenstoff kann mit verschiedenen Atomen verbunden sein kann, wie Wasserstoff, Sauerstoff, Stickstoff, Halogene usw. und auch mit Doppelbindungen. Dadurch kann der Kohlenstoff ganz verschiedene Oxidationszahlen annehmen, durchaus auch verschiedene Oxidationszahlen in einem Molekül vorkommen können.
Beispielhaft sei das bei der Oxidation des Alkohols Ethanol betrachtet:
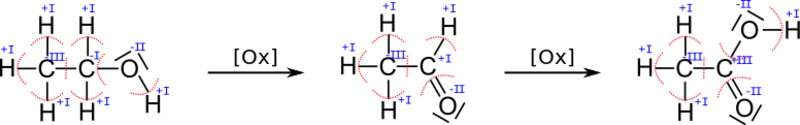
Obwohl sich die Menge an Sauerstoff vom Ethanol zum Ethanal nicht erhöht, ändert sich die Oxidationszahl.
Man braucht dann, um die Oxidationszahlen zu bestimmen, die Lewisschreibweise/Strukturformel des Moleküls. Dann sucht man sich die Elektronegativität der beteiligten Elemente heraus und spaltet gedanklich jede Bindung auf und somit das ganze Molekül in einzelne Ionen auf. Welches der Bindungspartner die jeweiligen Bindungselektronen bekommt, ist abhängig von der Elektronegativität: das Atom mit der größeren Elektronegativität erhält die Bindungselektronen zwischen den zwei Partnern. Diese gedachten Ionen werden dann meist eine Elektronenanzahl (bzw. die Valenzelektronen/Außenelektronen) haben, die nicht der normalen Anzahl entspricht. Daraus ergibt sich eine Ladung, die dann der Oxidationszahl entspricht.
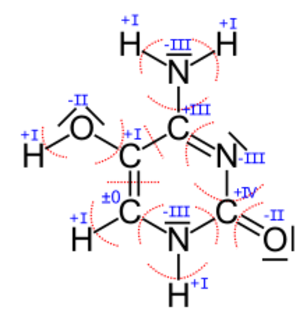
Die Zeichnung rechts zeigt die Vorgehensweise bei der Bestimmung der Oxidationszahlen der Atome im Molekül rechts, dass man als 5-Hydroxycytosin bezeichnet.
Vorab suchen wir für alle beteiligten Atomsorten die Elektronegativitätswerte heraus. Man sollte sich dazu auf eine Quelle beschränken, damit man nicht Werte aus verschiedenen Skalen mischt:
- EN(C) = 2.5 , EN(H) = 2.2, EN(O) = 3.5, EN(N) = 3.07
Betrachten wir anhand von zwei Kohlenstoff-Atomen und einem Stickstoff-Atom beispielhaft die Vorgehensweise:
- Das linke untere C (das die Oxidationszahl ±0 hat) ist unter anderem mit einem C verbunden. Da beide den gleichen EN-Wert haben, teilt man die zwei Bindungselektronenpaare gleichmäßig auf. Außerdem hängt daran ein N-Atom, dass einen höheren EN-Wert hat als der Kohlenstoff (EN(C) < EN(N)). Deshalb zählt man das Elektronenpaar zwischen diesen zwei Atomen zum Stickstoff. Die Bindung zum H-Atom wird zum C-Atom gezählt, da EN(C) > EN(H). Die roten Kreisbögen machen die Zuordnung deutlich. Nun zähle ich die Elektronen, die aufgrund von dieser Entscheidung/Markierung zu dem betrachteten C-Atom gehören und das sind 4 Stück (2 von der Bindung zum H und zweimal je 1 von der Doppelbindung zum anderen C-Atom). Damit hat dieses Kohlenstoff-Atom gleichviele Elektronen wie im normalen Zustand (laut Periodensystem) und somit ist die Oxidationszahl ±0.
- Das untere rechte C-Atom bekommt keines der Bindungselektronenpaare zugesprochen, da die Bindungspartner alle einen höheren EN-Wert haben. Ohne Elektronen fehlen also 4 Elektronen zum Normalzustand (weniger negative Ladung) und damit überwiegt die positive Ladung und zwar hat man dann +IV.
- Das untere mittlere Stickstoffatom hat nach der Aufteilung 8 Elektronen zugesprochen bekommen. Im Vergleich zu den 5 Außenelektronen, die es normalerweise hat sind das 3 Elektronen zuviel, also hat man die Oxidationszahl -III.
Zur Überprüfung können alle ermittelten Oxidationszahlen addiert werden. Ihre Summe muss insgesamt Null ergeben, wenn das Gesamtmolekül ungeladen ist - wie es vorher auch schon war.
Bestimme von den folgenden Molekülen die Oxidationszahlen der Kohlenstoffatome.
Redoxreaktionen bei Organischen Verbindungen
Bei den folgenden Aufgaben geht es um verschiedene Anwendungszwecke, bei den Redoxreaktionen vorkommen. Nicht immer hat die Abgabe bzw. Aufnahme der Elektronen ein so wichtige Bedeutung wie für die Batterien und Akkus als Stromquelle.
In diesen Aufgaben musst du immer die Oxidationszahlen bei den vorhandenen Molekülen bestimmen und dazu vorher die Strukturformeln bestimmen. Das ist nicht immer bei allen Verbindungen nötig. Gerade wenn mehrere Kohlenstoff-Atome in verschiedenen Kombinationen vorkommen, muss man diese untersuchen. Bestimmte Gruppen behalten meist ihre Oxidationszahlen, wie das Sulfat-Ion/-Gruppe in der ersten Aufgabe. Aufmerksam muss man sein, wenn Atome elementar auftreten, was bei Wasserstoff oder Sauerstoff vorkommen kann.
Der Nachweis des Atemalkoholgehaltes wurde vor der Einführung eines elektronischen Messgerätes "Chemisch" bestimmt.
- Die bereits 1953 entwickelten Blasröhrchen basieren auf einer chemischen Reaktion, wobei das in der Atemluft enthaltene Ethanol dabei mit den im Röhrchen befindlichen Chemikalien reagiert, was durch eine Farbveränderung sichtbar wird. Jedes Röhrchen enthält eine Mischung aus Kaliumdichromat und Schwefelsäure auf einer unreaktiven Trägersubstanz aus Kieselgel. Wird mit der Ausatemluft Ethanol durch diese Mischung geblasen, so wird das Ethanol zu Acetaldehyd (= Ethanal) oxidiert und das orangerote Kaliumdichromat zu grünem Chrom(III)-sulfat reduziert. Die Schwefelsäure dient als Protonendonator, da die Reaktion im sauren Milieu stattfindet. Außerdem bindet sie das entstehende Wasser, um eine Weiterreaktion des Acetaldehyds zu vermeiden. Die Länge der Verfärbung des Packungsbetts gibt einen groben Hinweis auf den Gehalt an Ethanol in der Atemluft. Mittels einer aufgedruckten Linie kann die Überschreitung eines Grenzwerts kenntlich gemacht werden. Die Reaktion läuft wie folgt ab:
Aufgabe: Bestimme die Oxidationszahlen, um nachzuweisen, dass eine Oxidation und eine Reduktion stattfinden.
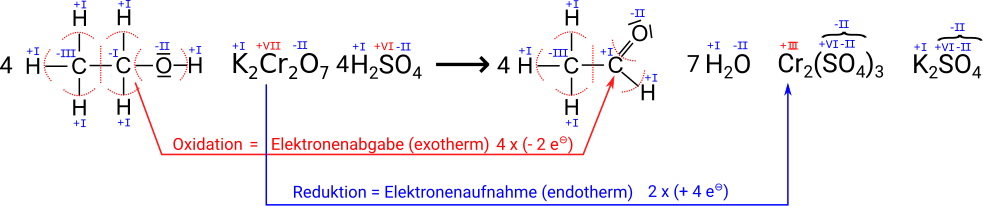
Die rot geschriebenen Oxidationszahlen ergeben sich aus den anderen, die man mit Hilfe der Regeln aus der Tabelle bestimmten kann. Bei dem Sulfat-Ion muss man sich eigentlich nicht um die Oxidationsstufen kümmern, da das Teilchen immer identisch ist und damit insgesamt immer die gleiche Ladung hat -2 hat.
Ich würde bei dem Einzeichnen der Pfeile auch genau von dem einen C-Atom ausgehen und nicht einfach von dem gesamtem Molekül aus. Ebenso bei der Pfeilspitze, dass genau das C-Atom das Ziel ist, bei dem sich die Oxidationszahl geändert hat.
Aufgabe: Bestimme die Oxidationszahlen und stelle fest, wo die Oxidation und wo die Reduktion stattfindet.
Das Tollensreagenz ist eine ammoniakalische Silbernitrat-Lösung, welche man herstellt, indem man zu einer Silbernitrat-Lösung so lange konzentrierte Ammoniak-Lösung hinzutropft, bis der entstehende braune Niederschlag von Silber(I)-oxid(Ag2O) in den löslichen Diamminsilber(I)-komplex ([Ag(NH3)2]+) übergeht.
Zum Nachweis gibt man zu einer wässrigen Lösung, der zu testenden Substanz im Reagenzglas Tollens-Reagnz und erwärmt diese im Wasserbad für wenige Minuten auf ca. 70 °C.Der Nachweis ist positiv, wenn sich durch Fällung von elementarem Silber die Lösung schwarz verfärbt und sich an der Innenwand des Reagenzglases Silber abscheidet, was zur Bildung eines spiegelnden Belages führt.
Aufgabe:
- Bestimme die sich ändernde Oxidationsstufen für die Oxidation von Ethanal zu Ethansäure/Essigsäure und ergänze zu einer Reaktion, bei der das Ethanal mit Hydroxid-Ionen reagiert unter Abgabe von Wasser.
- Die Reduktion geschieht von den Silber-Ionen hin zu elementarem Silber. Schreibe die Gleichung dafür auf.
- Kombiniere die zwei Teil-Reaktionen zu einer Gesamt-Reaktion und gleiche dazu die Elektronen aus.
Erster Schritt: Lewisschreibweisen für das Ethanal und die Essigsäure aufzeichnen und die Oxidationsstufen bestimmen. Eigentlich reicht die Oxidationsstufe beim rechten C, da sich beim linken nichts verändert.

Schreibe die Oxidationsreaktion nun in einer Reaktionsgleichung auf und ergänze , und Elektronen, bis es passt.
Die Reduktion ist recht einfach:
Nun schaut man, ob bei Oxidations und Reduktion gleich viele Elektronen frei werden bzw. gebraucht werden und gleicht dies aus. Dann kann man die zwei Reaktionen kombinieren und die Elektronen wegstreichen.