Chemie-Lexikon/Redoxreaktionen mit Elektronenübertragung: Unterschied zwischen den Versionen
Markierung: Quelltext-Bearbeitung 2017 |
Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 83: | Zeile 83: | ||
|3=Hervorhebung2}} | |3=Hervorhebung2}} | ||
{{Box|AUFGABE X - Wiederholung Säureanionen | {{Box|AUFGABE X - Wiederholung Säureanionen|2= | ||
Da wir bei den folgenden Aufgaben öfters mehratomige Ionen anschauen, wiederholen wir an der Stelle noch einmal einige Namen dieser Ionen, die Säurenrestanionen sind und auch wie man Ionenverbindungen benennt und die Formel angibt. | Da wir bei den folgenden Aufgaben öfters mehratomige Ionen anschauen, wiederholen wir an der Stelle noch einmal einige Namen dieser Ionen, die Säurenrestanionen sind und auch wie man Ionenverbindungen benennt und die Formel angibt. Nachdem wir geklärt haben, wie man bei mehratomigen Ionen die Oxidationszuahl bestimmt, werden wir das Arbeitsblatt wieder zur Hand nehmen. | ||
: Download: Datei:ARBEITSBLATT Ionen, Säuren, Ladungen, Namen.pdf | |||
|3=Hervorhebung1}} | |||
Bei den einzelnen Ionen, vor allem den Hauptgruppen-Elementen, nutzen wir die Hauptgruppennummer, um die Ladung der Metall-Ionen zu bestimmen. Dabei wird die Edelgasregel benutzt. Diese Edelgasregel ist zwar wichtig und richtig, aber sie gilt gerade bei Elementen ab der 3. Periode nicht mehr so streng. Das liegt vor allem daran, dass ab der 3. Schale Platz für mehr als 8 Elektronen ist. | |||
Wie schon erwähnt, spielt die Elektronegativität ein Rolle. Allerdings werden wir, statt immer ins PSE gucken zu müssen, einige Regeln festhalten, mit denen man auch ohne die Elektronegativität entscheiden kann, wie die Oxidationszahl eines Atoms in der Verbindung ist. Hinter diesen Regeln steht aber die Elektronegativität, denn in einer Verbindung werden bindende Elektronenpaare gedanklich dem elektronegativeren Bindungspartner zugewiesen (''Fachbegriff: heterolytische Spaltung''). | |||
|3 | |||
{| class="wikitable" | |||
|- | |||
! Nr. | |||
! style="width:40%"|Regel | |||
! Erklärung | |||
!style="width:30%"| Beispiele | |||
|- | |||
| 1 || '''Atome im elementaren Zustand haben immer die Oxidationszahl ±0''' || Die Atome haben die Elektronenanzahl, die zum Kern passt, also ist die Ladung 0 || I<sub>2</sub>, C, O<sub>2</sub>, P<sub>4</sub>, S<sub>8</sub> | |||
|- | |||
| 2 || '''Bei einatomigen Ionen entspricht die Oxidationszahl der Ionenladung'''|| wie bisher || Cu<sup>2+</sup> hat die Oxidationszahl +II, <br />Ag<sup>+</sup> hat die Oxidationszahl +I | |||
|- | |||
| 3 || '''Die Summe aller Oxidationszahlen in einer Verbindung/einem Molekül entspricht der Ladung''' | |||
|| Die Gesamt-Ladung (e<sup>-</sup> und p<sup>+</sup>) muss stimmen. Das kann bei einer neutralen Verbindung zusammen Null sein, bei einem geladenen Molekül ist es dessen Ladung. | |||
||CH<sub>4</sub> <br />→ C -IV und H je +I also -4 + 4*(+1) = 0<br />SO<sub>4</sub><sup>2-</sup><br />→ S + VI und O -II also +6 + 4*(-2) = -2 | |||
|- | |||
| 4 || '''Fluor hat in Verbindungen immer die Oxidationszahl −I''' || Wegen der höchsten Elektronegativität|| KF, HF, ... | |||
|- | |||
| 5 || '''Sauerstoff hat meist die Oxidationszahl −2''' <br /><small><u>Ausnahmen:</u> In Peroxiden (mit -O-O-) und in Verbindungen mit Fluor.</small> | |||
|| Die Fluor-Regel hat eine höhere Priorität! | |||
|| H<sub>2</sub>O<sub>2</sub> → O -I und H +I, OF<sub>2</sub> → O +II und F -I | |||
|- | |||
| 6 || '''Weitere Halogenatome (Cl, Br, I) haben meist die Oxidationszahl −I''' <br /><small><u>Ausnahmen:</u> In Verbindungen mit Fluor, Sauerstoff und einem anderen Halogen mit höherem EN-Wert</small> | |||
|| Die vorherigen Regeln haben Vorrang und wegen der Defintion der Elektronegativität | |||
|| ClO<sub>2</sub> → Cl +IV und O -II<br />BrCl → Br +I und Cl -I | |||
|- | |||
| 7 || '''Metallatome haben in Verbindungen immer eine positive Oxidationszahl'''<br /><small><u>Ausnahme:</u> Halbmetalle können sich auch wie Nichtmetalle verhalten.</small> | |||
|| Metalle geben Elektronen leicht ab. || Na<sup>+</sup>, Hg<sup>2+</sup>, Al<sup>3+</sup>, Si<sup>4+</sup>, As<sup>5+</sup>, ... <br /><u>aber:</u> Natriumarsenid Na<sub>3</sub>As → Na +I und As -III | |||
|- | |||
| 8 || '''Alkalimetalle haben als Oxidationszahl +I und Erdalkalimetalle +II''' || Ergibt sich aus der Edelgasregel. || Beispiel | |||
|- | |||
| 9 || '''Wasserstoffatome bekommen die Oxidationszahl +I''' <br /><small><u>Ausnahmen:</u> Wenn Wasserstoff mit „elektropositiveren“ Atomen wie Metallen oder sich selbst direkt verbunden ist.</small> | |||
|| Wegen der Defintion der Elektronegativität. | |||
|| H<sub>2</sub>O → H +I und O -II und HCl → H +I und Cl -I <br /> <u>aber:</u> Natrium<u>hydrid</u> NaH → Na +I und H -I | |||
|- | |||
|} | |||
Abschließend ist ein Blick nach "draußen" vielleicht einmal interessant mit der {{wpde|Liste_der_Oxidationsstufen_der_chemischen_Elemente|Liste aller möglichen Oxidationszahlen}} und einen [http://www.nature.com/nature/journal/v514/n7523/full/nature13795.html Artikel der Zeitschrift "Nature"], wo von dem Element mit der bisher höchsten Oxidationsstufe +IX berichtet wird. | |||
Version vom 2. Dezember 2018, 13:33 Uhr
In der Mittelstufe werden die Begriffe Reduktion und Oxidation meist im Zusammenhang mit Verfahren zur Gewinnung von Metallen besprochen, wobei eine Übertragung von Sauerstoff stattfindet.
Wiederholung: Redoxreaktionen als Sauerstoffübertragungsreaktionen
In der Mittelstufe kommen Redoxreaktionen im Rahmen der Verfahren zur Gewinnung von Metallen zur Sprache. Typischerweise betrachtet man die Reduktion von Kupfererzen mit Hilfe von Kohle und den Hochofen-Prozess. Aber auch bei der Thermitreaktion handelt es sich um ein Redoxreaktion:
Hier findet zum einen die Oxidation von Aluminium statt, hin zu . Zum anderen die Reduktion von hin zu Eisen.
Beide Teil-Reaktionen haben eine Funktion in der Gesamtreaktion.
- Die Oxidation von Aluminium liefert die für die Reduktion benötigte Energie, denn Oxidationen sind immer exotherm und Reduktionen endotherm. Aluminium ist daher auch das Reduktionsmittel.
- Die Reduktion von führt zur Freisetzung von Sauerstoff, was die Oxidation begünstigt und damit verstärkt. wirkt damit als Oxidationsmittel.
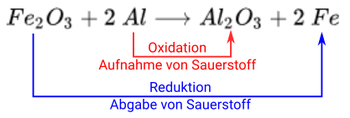
Noch einmal kompakt die Begriffe zusammengefasst:
- Oxidation = Reaktion mit Aufnahme von Sauerstoff
- Reduktion = Reaktion mit Abgabe von Sauerstoff
- Oxidationsmittel = Stoff, der die Oxidation ermöglicht, indem er selber Reduziert wird.
- Reduktionsmittel = Stoff, der die Reduktion ermöglicht, indem er selber oxiddiert.
Redoxreaktionen ohne Sauerstoff
Betrachtet man Reaktionen an denen kein Sauerstoff beteiligt ist, dann kann man Gemeinsamkeiten zu den Reaktionen mit Sauerstoff erkennen.⟶
Beispiel:
In beiden Reaktionen geben die Kupferatome Elektronen ab und es entstehen
Das heißt, in beiden Beispiel reagiert das Kupfer genauso: es gibt sowohl bei der Reaktion mit Sauerstoff Elektronen ab, also auch bei der Reaktion von Kupfer mit Schwefel.
Geschichtliches und Verallgemeinerung
Der Begriff Oxidation wurde ursprünglich von dem französischen Chemiker Antoine Laurent de Lavoisier geprägt, der damit die Reaktionen von Elementen und chemischen Verbindungen mit dem Element Sauerstoff (Oxygenium, franz: oxygène) und dessen Aufnahme, unter Bildung von Oxiden, beschreiben wollte. Als Lavoisier die Theorie in den 1780er Jahren veröffentlichte, hatte er anfänglich gegen die Anhänger der Phlogiston-Theorie zu kämpfen, konnte sich aber durchsetzen.
Später erfolgte eine Erweiterung des Begriffes, indem man Reaktionen mit einbezog, bei denen einer Verbindung Wasserstoffatome entzogen wurden (Dehydrierung). Auf Grundlage der Ionentheorie und des Bohrschen Atommodells konnte die Oxidation schließlich unter Betrachtung der Aufnahme und Abgabe von Elektronen interpretiert und verallgemeinert werden.
Daher werden heute die Begriffe zu den Redoxreaktionen mit Hilfe der Aufnahme und Abgabe von Elektronen definiert.
- Oxidation = Elektronenabgabe
- Reduktion = Elektronenaufnahme
- Reduktionsmittel = Stoff, der beim Reaktionspartner die Reduktion bewirkt, indem er ihm Elektronen abgibt
- Oxidationsmittel = Stoff, der beim Reaktionspartner die Oxidation bewirkt, indem er ihm Elektronen abnimmt
- Oxidation = Sauerstoffaufnahme oder Elektronenabgabe
- Reduktion = Sauerstoffabgabe oder Elektronenaufnahme
- Reduktionsmittel = Stoff, der beim Reaktionspartner die Reduktion bewirkt, indem er ihm Elektronen abgibt
- Oxidationsmittel = Stoff, der beim Reaktionspartner die Oxidation bewirkt, indem er ihm Elektronen abnimmt
Oxidationszahl
Um festzustellen, ob eine Oxidation oder eine Reduktion bei einem Redoxpaar stattfindet haben wir bisher immer die Ladungen der Ionen betrachtet. Das ist bei zusammengesetzen Ionen, wie oder nicht möglich, da das geladene Teilchen ein zusammenhängendes Molekül ist.
Man nutzt dann die Oxidationszahl (manchmal auch Oxidationsstufe, Oxidationswert, elektrochemische Wertigkeit), die die theoretische Ionenladung eines Atoms innerhalb einer chemischen Verbindung oder eines mehratomigen Ions angibt. Dabei geht man davon aus, dass das zusammengesetzte Molekül in Ionen zerlegt wird. Anders als bei den tatsächlichen Ionenladungen, die als Zahl mit nachgestelltem oder geschrieben werden, wird bei Oxidationszahlen das + oder − als Vorzeichen vorangestellt und die Zahl mit römischen Ziffern angegeben. Im Falle der Oxidationszahl Null wird ±0 geschrieben.
Da wir bei den folgenden Aufgaben öfters mehratomige Ionen anschauen, wiederholen wir an der Stelle noch einmal einige Namen dieser Ionen, die Säurenrestanionen sind und auch wie man Ionenverbindungen benennt und die Formel angibt. Nachdem wir geklärt haben, wie man bei mehratomigen Ionen die Oxidationszuahl bestimmt, werden wir das Arbeitsblatt wieder zur Hand nehmen.
- Download: Datei:ARBEITSBLATT Ionen, Säuren, Ladungen, Namen.pdf
Bei den einzelnen Ionen, vor allem den Hauptgruppen-Elementen, nutzen wir die Hauptgruppennummer, um die Ladung der Metall-Ionen zu bestimmen. Dabei wird die Edelgasregel benutzt. Diese Edelgasregel ist zwar wichtig und richtig, aber sie gilt gerade bei Elementen ab der 3. Periode nicht mehr so streng. Das liegt vor allem daran, dass ab der 3. Schale Platz für mehr als 8 Elektronen ist.
Wie schon erwähnt, spielt die Elektronegativität ein Rolle. Allerdings werden wir, statt immer ins PSE gucken zu müssen, einige Regeln festhalten, mit denen man auch ohne die Elektronegativität entscheiden kann, wie die Oxidationszahl eines Atoms in der Verbindung ist. Hinter diesen Regeln steht aber die Elektronegativität, denn in einer Verbindung werden bindende Elektronenpaare gedanklich dem elektronegativeren Bindungspartner zugewiesen (Fachbegriff: heterolytische Spaltung).
| Nr. | Regel | Erklärung | Beispiele |
|---|---|---|---|
| 1 | Atome im elementaren Zustand haben immer die Oxidationszahl ±0 | Die Atome haben die Elektronenanzahl, die zum Kern passt, also ist die Ladung 0 | I2, C, O2, P4, S8 |
| 2 | Bei einatomigen Ionen entspricht die Oxidationszahl der Ionenladung | wie bisher | Cu2+ hat die Oxidationszahl +II, Ag+ hat die Oxidationszahl +I |
| 3 | Die Summe aller Oxidationszahlen in einer Verbindung/einem Molekül entspricht der Ladung | Die Gesamt-Ladung (e- und p+) muss stimmen. Das kann bei einer neutralen Verbindung zusammen Null sein, bei einem geladenen Molekül ist es dessen Ladung. | CH4 → C -IV und H je +I also -4 + 4*(+1) = 0 SO42- → S + VI und O -II also +6 + 4*(-2) = -2 |
| 4 | Fluor hat in Verbindungen immer die Oxidationszahl −I | Wegen der höchsten Elektronegativität | KF, HF, ... |
| 5 | Sauerstoff hat meist die Oxidationszahl −2 Ausnahmen: In Peroxiden (mit -O-O-) und in Verbindungen mit Fluor. |
Die Fluor-Regel hat eine höhere Priorität! | H2O2 → O -I und H +I, OF2 → O +II und F -I |
| 6 | Weitere Halogenatome (Cl, Br, I) haben meist die Oxidationszahl −I Ausnahmen: In Verbindungen mit Fluor, Sauerstoff und einem anderen Halogen mit höherem EN-Wert |
Die vorherigen Regeln haben Vorrang und wegen der Defintion der Elektronegativität | ClO2 → Cl +IV und O -II BrCl → Br +I und Cl -I |
| 7 | Metallatome haben in Verbindungen immer eine positive Oxidationszahl Ausnahme: Halbmetalle können sich auch wie Nichtmetalle verhalten. |
Metalle geben Elektronen leicht ab. | Na+, Hg2+, Al3+, Si4+, As5+, ... aber: Natriumarsenid Na3As → Na +I und As -III |
| 8 | Alkalimetalle haben als Oxidationszahl +I und Erdalkalimetalle +II | Ergibt sich aus der Edelgasregel. | Beispiel |
| 9 | Wasserstoffatome bekommen die Oxidationszahl +I Ausnahmen: Wenn Wasserstoff mit „elektropositiveren“ Atomen wie Metallen oder sich selbst direkt verbunden ist. |
Wegen der Defintion der Elektronegativität. | H2O → H +I und O -II und HCl → H +I und Cl -I aber: Natriumhydrid NaH → Na +I und H -I |
Abschließend ist ein Blick nach "draußen" vielleicht einmal interessant mit der Liste aller möglichen Oxidationszahlen![]() und einen Artikel der Zeitschrift "Nature", wo von dem Element mit der bisher höchsten Oxidationsstufe +IX berichtet wird.
und einen Artikel der Zeitschrift "Nature", wo von dem Element mit der bisher höchsten Oxidationsstufe +IX berichtet wird.




