Oberstufen-Chemiebuch Kontextorientiert/Kernreaktionen - Sonderfall Radioaktivität: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
K (Bot: Ergänze Kategorie Chemie) |
||
| Zeile 111: | Zeile 111: | ||
[[Kategorie:Elementarteilchen]] | [[Kategorie:Elementarteilchen]] | ||
[[Kategorie:ChemieUnfertig]] | [[Kategorie:ChemieUnfertig]] | ||
[[Kategorie:Chemie]] | |||
Version vom 23. April 2022, 14:11 Uhr
Ein Video, dass dich ausführlich in das Thema Radioaktivität einführt und auch erklärt, warum einige Atom-Sorten radioaktiv sind, findest du hier: Vorlage:Video Ivi-Unterricht - Radioaktivität Anmerkung: Die genannten Voraussetzung passen nicht zu unserem Unterricht. Uns reicht erst einmal das Kern-Hülle-Modell!
Radioaktivität? Das ist doch gefährlich, oder?
Darauf kann man eine klare Antwort geben ... ja und nein!
Radioaktivität ist ein natürlicher Vorgang und wurde nicht vom Menschen erfunden. Die gesamte Welt und damit auch die Menschen sind ständig Radioaktiver Strahlung ausgesetzt. Die Ursache dafür sind natürliche Strahlenquellen, die unabhängig vom Menschen entstanden sind und existieren. Aus dem Weltall gelangt die kosmische Strahlung auf die Erde. Aufgrund der schützenden Lufthülle ist die Stärke dieser Strahlung aber von der Höhen abhängig. Im Flugzeug oder als Astronaut bekommt man dementsprechend mehr davon ab.
Eine weitere Strahlungsquelle sind die natürlichen radioaktiven Isotope in den Böden und Gesteinen der Erdkruste vorkommen. Sie wird als terrestrische Strahlung bezeichnet wird. Ursache sind Isotope, die vor der Entstehung des Sonnensystems gebildet wurden und aufgrund ihrer langen Halbwertzeit noch übrig geblieben sind. Einige magmatische Gesteine, wie zum Beispiel das Granit, weisen erhöhte Gehalte von Uran und Thorium auf.
Aus dem Boden gelangen die natürlichen Radionuklide in Wasser, Pflanzen und Tiere und damit in die Nahrung des Menschen. Alle Nahrungsmittel und auch das Wasser enthalten geringe Konzentrationen natürlicher Radionuklide. Am häufigsten ist auf der Erde übrigens das radioaktive Isotop 40K.
Eine besondere Stellung unter den natürlichen radioaktiven Isotopen nimmt das Radon ein. 222Rn ist ein radioaktives Edelgas, das aus dem Boden stammt und in geringer Konzentration praktisch überall vorkommt. Es entsteht aus dem Zerfall von Uran. Im Freien wird es rasch verdünnt, in Wohnungen kann es sich jedoch unter Umständen zu höheren Konzentrationen anreichern, insbesondere in einigen Gebieten Deutschlands, in denen besondere geologische Verhältnisse existieren.
Nun ist es klar, dass radioaktive Strahlung nicht so gefährlich sein kann, dass jeder Kontakt damit sofort zum Tode führen würde. Sonst wäre die Erde ja schon längst entvölkert und es gäbe auch keine Tiere mehr, die ja genauso darunter leiden würden.
Tatsächlich kann radioaktive Strahlung zu Schäden führen. Allerdings ist unser Körper darauf eingestellt und kann zufällig auftretende Schäden alleine reparieren. Je stärker die Belastung durch Strahlung aber ist, um so schwieriger ist es für den Körper, alles zu reparieren und so kann es dann vorkommen, dass es sich negativ auswirkt.
Hinsichtlich der Gefährlichkeit von Radioaktivität kann man verschiedene Risiken unterscheiden:
- Strahlenbelastung von außen
- Kontamination (Verunreinigung) der Haut mit radioaktivem Material
- Inkorporation (Aufnahme) radioaktiver Substanz in den Körper durch Einatmen oder Essen/Trinken.
Überblick über die wichtigsten Zerfallstypen
Es werden drei hauptsächliche Zerfallsarten unterschieden: Alpha-, Beta- und Gamma-Zerfall. Da man zum Zeitpunkt ihrer Entdeckung noch nicht wusste, um welche Vorgänge es sich handelte, bezeichnete man die 3 Strahlenarten einfach in der Reihenfolge zunehmenden Durchdringungsvermögens mit den ersten 3 Buchstaben des griechischen Alphabets.
Die bei den Kernreaktionen freiwerdende Energiemenge lässt sich mit Massen"defekten" erklären, die schon 1930 experimentell nachgewiesen wurden. Die "verschwundene" Masse wird in Energie umgewandelt und lieferte damit den Beweis für das 1905 von Albert Einstein im Rahmen der speziellen Relativitätstheorie entdeckte Naturgesetz, das besagt das die Masse m und Ruheenergie E eines Objekts zueinander proportional sind:
Alpha-Strahlung
Beim Alpha-Zerfall verringert sich der ursprüngliche Kern durch die Abgabe eines Alpha-Teilchens, das aus zwei Protonen und zwei Neutronen besteht. Damit verringert sich die Ordnungszahl des Atomkerns um 2 und die Massenzahl um 4.

Ein etwas kräftigeres Blatt Papier oder einige Zentimeter Luft reichen im Allgemeinen schon aus, um Alphateilchen vollständig abzuschirmen. In einer Nebelkammer sehen die durch Alphastrahlung erzeugten Spuren, verglichen mit denen von ähnlich energiereichen Betastrahlen, kürzer und dicker aus.

Alphastrahlung, die von außen auf den menschlichen Körper wirkt, ist selbst relativ ungefährlich, da die Alphateilchen aufgrund ihrer geringen Eindringtiefe überwiegend nur in die oberen, toten Hautschichten eindringen. Wird durch Einatmen oder Aufnahme mit der Nahrung ein Alphastrahler in dem Körper eingelagert, so ist es dagegen sehr schädlich, da in diesem Fall nicht nur die toten Hautschichten, sondern lebende Zellen geschädigt werden. Insbesondere die Anreicherung eines mit Alphastrahlung zerfallenden Isotops (die Physiker nennen es meist Nuklid!) in einem Organ führt zu einer hohen Belastung dieses Organs, da dabei eine hohe Strahlendosis ihre schädigende Wirkung auf kleinem Raum und auf wichtige Körperzellen ausüben kann. Die Folgeschäden bezeichnet man dann als Strahlenkrankheit.
Ein konkretes Beispiel für einen Alpha-Zerfall ist z.B.
- .
Allgemein kann man einen Alpha-Zerfall so beschreiben:
- Der Mutterkern X mit Nukleonenzahl A und Protonenzahl Z zerfällt unter Aussendung eines Alphateilchens in den Tochterkern Y mit einer um 4 verminderten Nukleonenzahl und um 2 verminderten Protonenzahl.
Beta-Strahlung
Beim Beta-Minus-Zerfall wird aus dem Atomkern ein Elektron ausgestoßen. Ein im Atomkern vorhandenes Neutron wandelt sich in ein Proton und ein Elektron um. Das Elektron wird dabei abgeben und entspricht der β-Strahlung. Dadurch ändert sich die Ordnungszahl um 1, die Massenzahl bleibt gleich.
Ein typischer β−-Strahler ist [198Au. Hier lautet die Umwandlung in Formelschreibweise:
Die dabei stattfindende Umwandlung eines Neutrons in ein Proton und Elektron kann man so beschreiben:
 ) ) |
β−-Strahlung (Protonen rot, Neutronen blau) |
Ist der menschliche Körper Betastrahlen ausgesetzt, werden nur Hautschichten geschädigt. Dort kann es aber zu intensiven Verbrennungen und daraus resultierenden Spätfolgen wie Hautkrebs kommen. Sind die Augen der Strahlung ausgesetzt, kann es zur Linsentrübung kommen. Werden Betastrahler in den Körper aufgenommen (man nennt das inkorporiert), können hohe Strahlenbelastungen in der Umgebung der strahlenden Atome die Folge sein.
Besonders verherrend sind Elemente, die im Körper an einer bestimmten Stelle konzentriert vorliegen.Bekannt ist, dass Schilddrüsenkrebs als Folge von radioaktivem Iod-131 (131I) auftreten kann, das sich in der Schilddrüse sammelt. Ähnlich ist es bei Strontium-90 (90Sr) das zu Knochenkrebs und Leukämie führen kann, da sich Strontium wie Calcium in den Knochen anreichert.
Aus diesem Grund werden auch als Vorsorgemaßnahme für mögliche Unfälle in Atomkraftwerken hochdosierte Iod-Präperate bereitgestellt. Die hohe Iod-Dosis soll die Einlagerung der von außen kommenden radioaktiven Iod-Isotope verhindern, indem dem Körper ausreichend Iod zur Verfügung gestellt wird, so dass der Bedarf mehr als gedeckt ist. Das Bundesministerium für Umwelt, Naturschutz, Bau und Reaktorsicherheit bietet auf einer Seite ausführliche Informationen zu dieser sogenannten Jod-Blockade an.
Gamma-Strahlung
Ein Gamma-Zerfall tritt meist als unmittelbare Folge eines Alpha- bzw. Beta-Zerfalls auf. Massen- und Ordnungszahl bleiben dabei gleich, jedoch ändert sich der Anregungszustand des Kerns.
Im weiteren Sinne wird mit Gammastrahlung jede elektromagnetische Strahlung mit Energien über etwa 200 keV bezeichnet, unabhängig von der Art ihrer Entstehung. Gamma-Strahlen dürfen nicht mit Röntgenstrahlung verglichen werden, da Röntgenstrahlung schwächer ist.
 ) ) |
ɣ-Strahlung, es wird keine Materie frei, sondern nur elektromagnetische Strahlung. |
Wird Gammastrahlung in menschlichem, tierischem oder pflanzlichem Gewebe absorbiert, so bewirkt ihre Energie Ionisation oder führt zu anderen Vorgängen. Dabei treten teilweise im Gewebe Folgestrahlungen wie freigesetzte Elektronen und Röntgenstrahlung auf. Insgesamt ergeben sich – für den Organismus meist schädliche – Wirkungen durch das Aufbrechen chemischer Bindungen in lebenswichtigen Molekülen wie der DNA. Die Folgen können am bestrahlten Organismus selbst oder, durch Schädigung des Erbguts, an seinen Nachkommen als genetische Schäden auftreten.
Wie bei geladenen Teilchenstrahlungen nimmt die Intensität der Gammastrahlung mit der Eindringtiefe ab. Die Eindringtiefe hängt von der Wellenlänge der Gammastrahlung und von der Ordnungszahl des abschirmenden Materials ab. Je höher die Ordnungszahl (und damit auch meist die Masse), desto besser ist die Abschirmung. Blei ist deshalb das gängigste zum Strahlenschutz gegen Gammastrahlung verwendete Material.
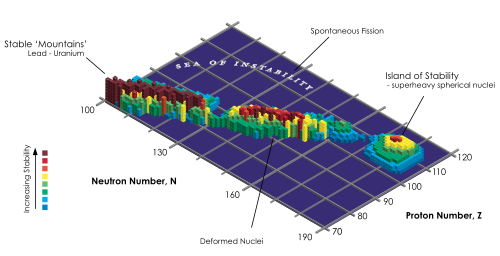
Ausblick - die Insel der Stabilität
Je schwerer die Elemente sind, desto instabiler sind die Atome bzw. Nuklide und desto schneller zerfallen sie.
Aufgrund eines Modell für den Kern, den man sich ebenfalls in Schalen aufgebaut vorstellt, erwartet man aber auch bei noch schwereren Elemente bestimmte Neutronen- und Protonenzahlen, bei denen der Kern eine höhere Stabilität als bei benachbarten Nukliden hat. Solche Kerne selbst werden auch als magische Kerne bezeichnet. Die sogenannten magischen Zahlen sind dann Anzahlen an Neutronen- und Protonenzahlen in Atomkernen. Dieses Stabilität lässt sich durch dieses Schalenmodell erklären. Auf dieser Basis werden auch Inseln der Stabilität bei Ordnungszahlen oberhalb der natürlich vorkommenden Elemente vorhergesagt.
Das Schalenmodell des Atomkerns (nicht der Elektronenhülle!) erklärt die magischen Zahlen damit, dass dort (vereinfacht gesagt) jeweils die äußerste „Schale“ vollständig besetzt, also abgeschlossen ist, ähnlich, wie die chemisch stabilen Edelgase durch abgeschlossene Außenschalen ihrer Elektronenhülle gekennzeichnet sind.
Oberhalb der natürlich vorkommenden Protonen- und Neutronenzahlen sagt die Theorie weitere solcher "Schalenabschlüsse" vorher (die magische Zahlen). Für Protonen erwartet man "Unterschalenabschlüsse" bei Anzahlen von Zahlen 114 und 120, also Elemente mit der Ordnungszahl 114 und 120. Tatsächlich konnte man bei dem zwar schon 1999 erzeugten aber erst 2011 benannten und offiziell ins Periodensystem aufgenomme Flerovium (Ordnungszahl 114) ein Isotop 285Fl erzeugen, das eine relativ lange Halbwertszeit von fünf Sekunden hat. Das ist im Vergleich zu den benachbarten Isotopen, deren Halbwertzeit nur einen Bruchteil von Sekunden beträgt, recht viel.

Das doppelt magische Isotop Fl-298 mit 184 Neutronen (Magische Anzahl für Protonen und Neutronen) erwartet man eine besonders lange Halbwertszeit. Es konnte allerdings noch nicht hergestellt werden.
Eine ganze Insel der Stabilität (ein von Glenn Seaborg![]() geprägter Begriff) mit diesem doppelt magischen Nuklid als Zentrum wird vermutet. Dabei ist der Begriff Stabilität aber wie vorhin beschrieben, nur relativ zu den umgebenden Nukliden zu verstehen. Stabile Nuklide, die keinerlei Radioaktivität aufweisen, sind jenseits von Blei nicht zu erwarten.
geprägter Begriff) mit diesem doppelt magischen Nuklid als Zentrum wird vermutet. Dabei ist der Begriff Stabilität aber wie vorhin beschrieben, nur relativ zu den umgebenden Nukliden zu verstehen. Stabile Nuklide, die keinerlei Radioaktivität aufweisen, sind jenseits von Blei nicht zu erwarten.