Benutzer:BirgitLachner/Chemie-Buch I zum Lehrplan in Rheinland-Pfalz/Ein erster Blick in die Atome - Eigenschaften der Salzartigen Verbindungen erklären: Unterschied zwischen den Versionen
(Änderung 37093 von BirgitLachner (Diskussion) rückgängig gemacht.) Markierung: Rückgängigmachung |
K (Bot: Ergänze Kategorie Chemie) |
||
| (11 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
Wir wollen versuchen die beobachteten Eigenschaften von Kochsalz - als Stellvertreter für die Gruppe der salzartigen Verbindungen - zu erklären. Anfangen werden wir dabei mit der Leitfähigkeit. | {{SORTIERUNG:{{SUBPAGENAME}}}}Wir wollen versuchen die beobachteten Eigenschaften von Kochsalz - als Stellvertreter für die Gruppe der salzartigen Verbindungen - zu erklären. Anfangen werden wir dabei mit der Leitfähigkeit. | ||
| Zeile 7: | Zeile 7: | ||
==Strom wird geleitet oder eben nicht == | ==Strom wird geleitet oder eben nicht == | ||
Um zu verstehen, warum eine Salzlösung Strom leitet, aber alle anderen betrachteten Stoffe (''Salz- und Zuckerkristall, Zuckerlösung, Wasser'') aber nicht, müssen wir uns zuerst einmal kurz anschauen, was überhaupt Strom ist. In der grundschule und auch in NaWi wird das ja als Thema schon angesprochen. | [[Datei:Maintenance de Sonelgaz.jpg|thumb|350x370px|Hier ist die Frage, ob etwas den Strom leitet oder nicht, überlebensnotwendig!]]Um zu verstehen, warum eine Salzlösung Strom leitet, aber alle anderen betrachteten Stoffe (''Salz- und Zuckerkristall, Zuckerlösung, Wasser'') aber nicht, müssen wir uns zuerst einmal kurz anschauen, was überhaupt Strom ist. In der grundschule und auch in NaWi wird das ja als Thema schon angesprochen. | ||
{{Box|WIEDERHOLUNG Strom|(Elektrischer) '''Strom''' ist bewegte Ladung.|Hervorhebung2}} | {{Box|WIEDERHOLUNG Strom|(Elektrischer) '''Strom''' ist bewegte Ladung.|Hervorhebung2}} | ||
| Zeile 68: | Zeile 68: | ||
Da Kochsalz als Feststoff ein Isolator ist, in flüssiger Form aber den Strom leitet, muss es einen anderen Grund geben. | Da Kochsalz als Feststoff ein Isolator ist, in flüssiger Form aber den Strom leitet, muss es einen anderen Grund geben. | ||
{{Box|ZUSAMMENFASSUNG|Auch im Kochsalz müssen geladene Teilchen vorkommen, denn nur so kann der elektrische Strom weitergeleitet werden. | {{Box|ZUSAMMENFASSUNG|2=Auch im Kochsalz müssen geladene Teilchen vorkommen, denn nur so kann der elektrische Strom weitergeleitet werden. | ||
Im festen Kochsalzkristall sind diese geladenen Teilchen aber nicht beweglich (''Feststoff = Teilchen haben eine feste Position''), so dass es nicht stromleitfähig ist. | Im festen Kochsalzkristall sind diese geladenen Teilchen aber nicht beweglich (''Feststoff = Teilchen haben eine feste Position''), so dass es nicht stromleitfähig ist. | ||
| Zeile 76: | Zeile 76: | ||
Daraus ergibt sich eine Tatsache, die der Vorstellung, die den Atomen ihren Namen gaben (''von altgriechisch ''atomos'' = unteilbar'') widerspricht! | Daraus ergibt sich eine Tatsache, die der Vorstellung, die den Atomen ihren Namen gaben (''von altgriechisch ''atomos'' = unteilbar'') widerspricht! | ||
{{Box|FAZIT Was folgt aus der Stromleitfähigkeit für unsere Atomvorstellung?| Atome sind keine kompakten Kugeln, die unzerstörbar sind. Die alte Atomvorstellung reicht nicht mehr aus, dies zu erklären! Wir müssen das Atommodell erweitern.|Hervorhebung2}} | {{Box|FAZIT Was folgt aus der Stromleitfähigkeit für unsere Atomvorstellung?|Atome sind keine kompakten Kugeln, die unzerstörbar sind. Die alte Atomvorstellung reicht nicht mehr aus, dies zu erklären! '''Wir müssen das Atommodell erweitern.'''|Hervorhebung2}} | ||
===Das Rosinenkuchenmodell | ===Das Rosinenkuchenmodell === | ||
[[Datei:JJ Thomson.jpg|Joseph J. Thomson 1896|thumb]]Der britische Physiker Joseph Thomson war ein britischer Physiker und Nobelpreisträger für Physik. Er entdeckte 1897 (etwa zeitgleich mit dem deutschen Physiker Emil Wiechert) das Elektron. | [[Datei:JJ Thomson.jpg|Joseph J. Thomson 1896|thumb]]Der britische Physiker Joseph Thomson war ein britischer Physiker und Nobelpreisträger für Physik. Er entdeckte 1897 (''etwa zeitgleich mit dem deutschen Physiker Emil Wiechert'') das Elektron. | ||
| Zeile 88: | Zeile 88: | ||
Kathodenstrahlröhren kann man technisch als Vorgänger der alten Fernsehen ansehen, also nicht die flachen Displays sondern die dicken und schweren Fernseher. | Kathodenstrahlröhren kann man technisch als Vorgänger der alten Fernsehen ansehen, also nicht die flachen Displays sondern die dicken und schweren Fernseher. | ||
<gallery widths=300 heights=200 style="text-align:center">> | |||
<gallery widths= | |||
Datei:J J Thomsons cathode ray tube with magnet coils, 1897. (9663807404).jpg|Die original Katheodenstrahlröhre von Thomson. | Datei:J J Thomsons cathode ray tube with magnet coils, 1897. (9663807404).jpg|Die original Katheodenstrahlröhre von Thomson. | ||
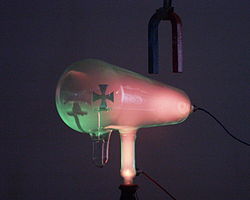
Datei:Katódsugarak mágneses mezőben(1).jpg|Bei der Kathodenröhre wird von der Kathode rechts durch das Anlegen einer Spannung Elektronen abgegeben, die auf die Anode zufliegen, hier in Form eines Kreuzes. | Datei:Katódsugarak mágneses mezőben(1).jpg|Bei der Kathodenröhre wird von der Kathode rechts durch das Anlegen einer Spannung Elektronen abgegeben, die auf die Anode zufliegen, hier in Form eines Kreuzes. | ||
| Zeile 96: | Zeile 94: | ||
Datei:Katódsugarak mágneses mezőben(4).jpg|Thomson stellt fest, dass die Teilchen, die das Leuchten verursachen, sich von Magneten ablenken lassen. | Datei:Katódsugarak mágneses mezőben(4).jpg|Thomson stellt fest, dass die Teilchen, die das Leuchten verursachen, sich von Magneten ablenken lassen. | ||
</gallery> | </gallery> | ||
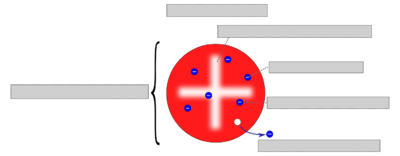
Dies war die erste Entdeckung und der Nachweis eines Teilchens, das kleiner als die Atome war. Darauf basierend entwickelte Thomson das Thomsonsche Atommodell (auch „Rosinenkuchen-“ oder „Plumpudding-Modell“), wonach die sehr kleinen Elektronen Teile der Atome sind und im Inneren der Atome eingebettet seien, wie Rosinen in einem Kuchenteig. | [[Datei:Syrup sponge pudding (13070658024).jpg|rahmenlos|267x267px]]Dies war die erste Entdeckung und der Nachweis eines Teilchens, das kleiner als die Atome war. Darauf basierend entwickelte Thomson das Thomsonsche Atommodell (auch „Rosinenkuchen-“ oder „Plumpudding-Modell“), wonach die sehr kleinen Elektronen Teile der Atome sind und im Inneren der Atome eingebettet seien, wie Rosinen in einem Kuchenteig. | ||
{{Box| | {{Box|AUFGABE 5 - Ordne die Begriffe zu:|2=[[Datei:Rosinenkuchenmodell zum Ausfüllen.svg|right|400px]] | ||
Das Bild soll darstellen, wie sich Thomson sein Rosinenkuchenmodell vorstellte. Bearbeite das Bildzuordnungsquiz und versuche die Begriffe richtig zuzuordnen um damit Thomsons Idee zu verstehen. Trage nach der Kontrolle die richtigen Beschriftungen auf das ausgeteilte Arbeitsblatt ein und klebe es dann ins Heft. | Das Bild soll darstellen, wie sich Thomson sein Rosinenkuchenmodell vorstellte. Bearbeite das Bildzuordnungsquiz und versuche die Begriffe richtig zuzuordnen um damit Thomsons Idee zu verstehen. Trage nach der Kontrolle die richtigen Beschriftungen auf das ausgeteilte Arbeitsblatt ein und klebe es dann ins Heft. | ||
:→ [http://LearningApps.org/view1676408 Zum Quiz] | :→ [http://LearningApps.org/view1676408 Zum Quiz] | ||
}} | |3=Üben}} | ||
: | {{Box|AUFGABE 5 - Wie Thomson das Rosinenkuchenmodell herleitete:|2=Hast du verstanden, wie Thomson auf sein Atommodell kam? Und was es mit der Stromleitfähigkeit auf sich hat? Zur Kontrolle solltest du auf jeden Fall mal noch dieses Multiple-Choice-Quiz durchgehen. | ||
:→ [http://LearningApps.org/view1676394 Multiple-Choice-Quiz zum Rosinenkuchenmodell]|3=Üben}} | |||
===Ernest Rutherford und das Streuexperiment | ===Ernest Rutherford und das Streuexperiment === | ||
[[Datei:Ernest_Rutherford_LOC.jpg|thumb|Ernest Rutherford]]Ernest Rutherford (1871-1937 in Cambridge) war ein aus Neuseeland stammender Physiker, der zunächst als Assistent von Joseph J. Thomson in Cambridge arbeitete. Zunächst beschäftigte er sich mit der Verbesserung der Empfindlichkeit seines Detektors, mit dem er Radiowellen in einer Entfernung von etwa einer halben Meile nachweisen konnte. Thomson, der Rutherfords experimentelles Talent schnell erkannte, lud Rutherford 1896 ein, ihn bei seinen Untersuchungen der elektrischen Leitfähigkeit von Gasen zu unterstützen. Sie benutzten die wenige Monate zuvor entdeckten Röntgenstrahlen, um die Leitfähigkeit in den Gasen auszulösen. | [[Datei:Ernest_Rutherford_LOC.jpg|thumb|Ernest Rutherford]]Ernest Rutherford (1871-1937 in Cambridge) war ein aus Neuseeland stammender Physiker, der zunächst als Assistent von Joseph J. Thomson in Cambridge arbeitete. Zunächst beschäftigte er sich mit der Verbesserung der Empfindlichkeit seines Detektors, mit dem er Radiowellen in einer Entfernung von etwa einer halben Meile nachweisen konnte. Thomson, der Rutherfords experimentelles Talent schnell erkannte, lud Rutherford 1896 ein, ihn bei seinen Untersuchungen der elektrischen Leitfähigkeit von Gasen zu unterstützen. Sie benutzten die wenige Monate zuvor entdeckten Röntgenstrahlen, um die Leitfähigkeit in den Gasen auszulösen. | ||
| Zeile 122: | Zeile 118: | ||
* [[Simulationsexperiment_zum_Rutherfordschen_Streuversuch_mit_MW|Unterseite Simulation des Streuexperimentes]] | * [[Simulationsexperiment_zum_Rutherfordschen_Streuversuch_mit_MW|Unterseite Simulation des Streuexperimentes]] | ||
==Übungen zum Kern-Hülle-Modell | == Das Kern-Hülle-Modell == | ||
===Übungen zum Kern-Hülle-Modell === | |||
* [https://phet.colorado.edu/sims/html/build-an-atom/latest/build-an-atom_en.html Build an atom / Baue ein Atom] | * [https://phet.colorado.edu/sims/html/build-an-atom/latest/build-an-atom_en.html Build an atom / Baue ein Atom] | ||
* [https://phet.colorado.edu/sims/html/isotopes-and-atomic-mass/latest/isotopes-and-atomic-mass_en.html Isotopes and Atommassen/Isotope und Atommassen] | * [https://phet.colorado.edu/sims/html/isotopes-and-atomic-mass/latest/isotopes-and-atomic-mass_en.html Isotopes and Atommassen/Isotope und Atommassen] | ||
| Zeile 141: | Zeile 140: | ||
* | * | ||
=Weitere Eigenschaften der Salze betrachten und erklären = | ==Weitere Eigenschaften der Salze betrachten und erklären == | ||
Nachdem wir mit Hilfe der Ionen erklären konnten, warum Salzlösungen stromleitfähig sind, schauen wir uns noch einmal die restliche Eigenschaften an. Mit Hilfe des Buches und weiteren Medien, wie Simulationen, sollt ihr in euer Gruppe Gründe für die Eigenschaften von Salzen = Ionenverbindungen finden. | Nachdem wir mit Hilfe der Ionen erklären konnten, warum Salzlösungen stromleitfähig sind, schauen wir uns noch einmal die restliche Eigenschaften an. Mit Hilfe des Buches und weiteren Medien, wie Simulationen, sollt ihr in euer Gruppe Gründe für die Eigenschaften von Salzen = Ionenverbindungen finden. | ||
==Salze sind meist wasserlöslich == | ===Salze sind meist wasserlöslich === | ||
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | ||
{{Box|Die meisten Salze, also '''Verbindungen die aus Ionen''' bestehen, sind '''wasserlöslich'''}} | {{Box|Typische Eigenschaft von Salzen: Wasserlöslichkeit|Die meisten Salze, also '''Verbindungen die aus Ionen''' bestehen, sind '''wasserlöslich'''.|Hervorhebung1}} | ||
| Zeile 157: | Zeile 156: | ||
''Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!'' | ''Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!'' | ||
}} | |3=Üben}} | ||
| Zeile 168: | Zeile 167: | ||
<u>Beantwortet dann die folgenden Fragen zu "Water":</u> | <u>Beantwortet dann die folgenden Fragen zu "Water":</u> | ||
* Wie kommt es, dass die Ionen nicht mehr zusammenhalten? | * Wie kommt es, dass die Ionen nicht mehr zusammenhalten? | ||
}} | |3=Üben}} | ||
{{Box|7.3|Den Vorgang des Lösens kann in einer anderen Simulation besser angeschaut werden, die ihr euch als [https://youtu.be/FAsJX-qnGS0 Film] anschauen könnt. Beantwortet dazu folgende Fragen: | {{Box|7.3|Den Vorgang des Lösens kann in einer anderen Simulation besser angeschaut werden, die ihr euch als [https://youtu.be/FAsJX-qnGS0 Film] anschauen könnt. Beantwortet dazu folgende Fragen: | ||
| Zeile 175: | Zeile 174: | ||
* Obwohl die Ionen sich immer noch anziehen, werden die ersten Ionen aus dem Kristall abgetrennt. Wie wird verhindert, dass die Ionen nicht mehr so richtig zusammenkommen? | * Obwohl die Ionen sich immer noch anziehen, werden die ersten Ionen aus dem Kristall abgetrennt. Wie wird verhindert, dass die Ionen nicht mehr so richtig zusammenkommen? | ||
* Was ist die Voraussetzung dafür, dass sich das Salzkristall vollständig auflösen kann, dass heißt dass keine zwei Ionen mehr direkt nebeneinander liegen. | * Was ist die Voraussetzung dafür, dass sich das Salzkristall vollständig auflösen kann, dass heißt dass keine zwei Ionen mehr direkt nebeneinander liegen. | ||
}} | |3=Üben}} | ||
{{Box|7.4|2=Eine [http://www.chemie-interaktiv.net/html_flash/ff_loesung.swf weitere Simulation] zeigt das Auflösen des Salzes animiert aber nicht als chaotische Simulation. Überprüft die bisherigen Beobachtungen bei dieser Simulation noch einmal.}} | {{Box|7.4|2=Eine [http://www.chemie-interaktiv.net/html_flash/ff_loesung.swf weitere Simulation] zeigt das Auflösen des Salzes animiert aber nicht als chaotische Simulation. Überprüft die bisherigen Beobachtungen bei dieser Simulation noch einmal.|3=Üben}} | ||
| Zeile 184: | Zeile 183: | ||
* Was passiert, wenn man vom dem Kochsalz sehr viel ins Wasser gibt? | * Was passiert, wenn man vom dem Kochsalz sehr viel ins Wasser gibt? | ||
* Was könnte der Unterschied zwischen Kochsalz und einem schlecht löslichen Salz sein? | * Was könnte der Unterschied zwischen Kochsalz und einem schlecht löslichen Salz sein? | ||
}} | |3=Üben}} | ||
| Zeile 190: | Zeile 189: | ||
* Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren. Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte! | * Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren. Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte! | ||
* Überlegt welche der Simulationen ihr verwenden wollt und welche Aktionen gezeigt werden sollen, um diese Informationen verdeutlichen zu können. | * Überlegt welche der Simulationen ihr verwenden wollt und welche Aktionen gezeigt werden sollen, um diese Informationen verdeutlichen zu können. | ||
}} | |3=Üben}} | ||
==Salze haben meist hohe Schmelz- und Siedetemperaturen === | ===Salze haben meist hohe Schmelz- und Siedetemperaturen === | ||
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | ||
{{Box|Die meisten '''Salze haben hohe Schmelz- und Siedetemperaturen''', d.h. man muss sie stark erhitzen, bis die schmelzen. Dabei wird das Salz aber nicht zerstört (wie beim Zucker).}} | {{Box|Typische Eigenschaft von Salzen: Hohe Schmelz- und Siedetemperaturen|Die meisten '''Salze haben hohe Schmelz- und Siedetemperaturen''', d.h. man muss sie stark erhitzen, bis die schmelzen. Dabei wird das Salz aber nicht zerstört ''(wie beim Zucker!)''.|Hervorhebung1}} | ||
| Zeile 204: | Zeile 203: | ||
''Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!'' | ''Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!'' | ||
}} | |3=Üben}} | ||
{{Box|8.2|Informiert euch über die Schmelz- und Siedetemperaturen der folgenden Stoffe: | {{Box|8.2|Informiert euch über die Schmelz- und Siedetemperaturen der folgenden Stoffe: | ||
* Natriumchlorid, Calciumsulfat(Gips), Wasser, Pyrit, Methan, Ethanol (der Trinkalkohol), Calcit | * Natriumchlorid, Calciumsulfat(Gips), Wasser, Pyrit, Methan, Ethanol (der Trinkalkohol), Calcit | ||
Sortiert die Stoffe aufgrund der Siedetemperaturen in zwei Gruppen und begründet diese Einteilung.}} | Sortiert die Stoffe aufgrund der Siedetemperaturen in zwei Gruppen und begründet diese Einteilung.|3=Üben}} | ||
| Zeile 215: | Zeile 214: | ||
* Warum werden Stoffe, die keine geladenen Teilchen enthalten, schneller flüssig? | * Warum werden Stoffe, die keine geladenen Teilchen enthalten, schneller flüssig? | ||
* Was hält stärker zusammen? Einfache Teilchen die sich anziehen oder Ionen? Vermutet warum das so ist! | * Was hält stärker zusammen? Einfache Teilchen die sich anziehen oder Ionen? Vermutet warum das so ist! | ||
}} | |3=Üben}} | ||
| Zeile 221: | Zeile 220: | ||
* Was ist der Unterschied zwischen den beiden Arten von Teilchen, wenn sie erhitzt werden? | * Was ist der Unterschied zwischen den beiden Arten von Teilchen, wenn sie erhitzt werden? | ||
* Was könnten die gestrichelten Linien andeuten? | * Was könnten die gestrichelten Linien andeuten? | ||
}} | |3=Üben}} | ||
{{Box|8.5|Bereitet nun vor, wie ihr euren Mitschülern erklären wollt, das Salze hohe Schmelz- und Siedetemperaturen haben. Überlegt dazu: | {{Box|8.5|Bereitet nun vor, wie ihr euren Mitschülern erklären wollt, das Salze hohe Schmelz- und Siedetemperaturen haben. Überlegt dazu: | ||
* Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren. Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte! | * Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren. Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte! | ||
* Überlegt welche der Simulationen ihr verwenden wollt und welche Aktionen gezeigt werden sollen, um diese Informationen verdeutlichen zu können. | * Überlegt welche der Simulationen ihr verwenden wollt und welche Aktionen gezeigt werden sollen, um diese Informationen verdeutlichen zu können. | ||
}} | |3=Üben}} | ||
==Salze haben meist gerade Kanten und glatte Flächen == | ===Salze haben meist gerade Kanten und glatte Flächen === | ||
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | ||
{{Box|Salze bilden '''Kristalle mit glatten Flächen und geraden Kanten'''. Die Form ist typisch für eine Verbindung und kann deshalb auch für deren Identifikation verwende werden.}} | {{Box|Typische Eigenschaft von Salzen: Salze bilden Kristalle|Salze bilden '''Kristalle mit glatten Flächen und geraden Kanten'''. Die Form ist typisch für eine Verbindung und kann deshalb auch für deren Identifikation verwende werden.|Hervorhebung1}} | ||
| Zeile 240: | Zeile 239: | ||
''Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!'' | ''Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!'' | ||
}} | |3=Üben}} | ||
{{Box|9.2|Sucht im Internet und zum Beispiel auch auf der Seite [https://commons.wikimedia.org/wiki/Main_Page Wikimedia-Commons] nach verschiedenen Kristallformen (Stichwort: "crystal"). Die Kategorien "[https://commons.wikimedia.org/wiki/Category:Crystals Kristalle]" und "[https://commons.wikimedia.org/wiki/Category:Minerals Mineralien]" zeigen noch mehr Bilder. Ihr könnt natürlich auch auf Wikipedia schauen. | {{Box|9.2|2=Sucht im Internet und zum Beispiel auch auf der Seite [https://commons.wikimedia.org/wiki/Main_Page Wikimedia-Commons] nach verschiedenen Kristallformen (Stichwort: "crystal"). Die Kategorien "[https://commons.wikimedia.org/wiki/Category:Crystals Kristalle]" und "[https://commons.wikimedia.org/wiki/Category:Minerals Mineralien]" zeigen noch mehr Bilder. Ihr könnt natürlich auch auf Wikipedia schauen. | ||
Sucht euch möglichst verschiedene Formen an Kristallen aus und sammelt die Bilder in einem Textdokument (Bilder nicht zu groß, damit mehrere Bilder auf eine Seite passen). Speichert das fertige Dokument auf dem Verzeichnis i: und gebt mir Bescheid, damit ich es sichern kann. | Sucht euch möglichst verschiedene Formen an Kristallen aus und sammelt die Bilder in einem Textdokument (Bilder nicht zu groß, damit mehrere Bilder auf eine Seite passen). Speichert das fertige Dokument auf dem Verzeichnis i: und gebt mir Bescheid, damit ich es sichern kann. | ||
}} | |3=Üben}} | ||
{{Box|9.3|2=Schaut euch die [http://lab.concord.org/embeddable.html#interactives/samples/3-100-atoms.json Simulation hier] an, schaltet die Ladung = charge an (''so das man Ionen hat'') und stellt die Temperatur ganz hoch. Startet die Simulation, beobachtet erst, was passiert und senkt dann die Temperatur nach und nach. Macht das gleiche bei ungeladenen Teilchen, indem ihr das Häkchen bei "charge" entfernt". | {{Box|9.3|2=Schaut euch die [http://lab.concord.org/embeddable.html#interactives/samples/3-100-atoms.json Simulation hier] an, schaltet die Ladung = charge an (''so das man Ionen hat'') und stellt die Temperatur ganz hoch. Startet die Simulation, beobachtet erst, was passiert und senkt dann die Temperatur nach und nach. Macht das gleiche bei ungeladenen Teilchen, indem ihr das Häkchen bei "charge" entfernt". | ||
| Zeile 254: | Zeile 253: | ||
* Warum bilden sich die Kristalle erst bei niedrigeren Temperaturen? | * Warum bilden sich die Kristalle erst bei niedrigeren Temperaturen? | ||
* Wieso haben wir glatte Kanten bzw. warum sind glatte Kanten (eher) möglich? Im Gegensatz zu den ungeladenen Teilchen. | * Wieso haben wir glatte Kanten bzw. warum sind glatte Kanten (eher) möglich? Im Gegensatz zu den ungeladenen Teilchen. | ||
}} | |3=Üben}} | ||
{{Box|9.4|[[File:Sodiumchloride crystal 01.jpg|right|150px]]Überlegt euch mit Hilfe des Buches oder einer anderen Informationsquelle, warum Kochsalz Kristalle bilden kann, bei denen es quadratische/rechteckige Flächen gibt, die senkrechte aufeinander stehen. Zeichnet dazu ein Kochsalz-Kristall auf Teilchenebene mit den Ionen als Kugeln mit + oder - innen drin (''die Größe sollte sich leicht unterscheiden und verwendet auch verschiedene Farben'').}} | {{Box|9.4|2=[[File:Sodiumchloride crystal 01.jpg|right|150px]]Überlegt euch mit Hilfe des Buches oder einer anderen Informationsquelle, warum Kochsalz Kristalle bilden kann, bei denen es quadratische/rechteckige Flächen gibt, die senkrechte aufeinander stehen. Zeichnet dazu ein Kochsalz-Kristall auf Teilchenebene mit den Ionen als Kugeln mit + oder - innen drin (''die Größe sollte sich leicht unterscheiden und verwendet auch verschiedene Farben'').|3=Üben}} | ||
{{Box|9.5|Lassen sich mit dem Modell aus 9.4 auch glatte, schräge Flächen (''also mit 45° Winkel'') bei Kochsalzkristallen erklären?}} | {{Box|9.5|Lassen sich mit dem Modell aus 9.4 auch glatte, schräge Flächen (''also mit 45° Winkel'') bei Kochsalzkristallen erklären?|3=Üben}} | ||
| Zeile 266: | Zeile 265: | ||
* Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren. Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte! | * Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren. Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte! | ||
* Überlegt welche der Simulationen ihr verwenden wollt und welche Aktionen gezeigt werden sollen, um diese Informationen verdeutlichen zu können. | * Überlegt welche der Simulationen ihr verwenden wollt und welche Aktionen gezeigt werden sollen, um diese Informationen verdeutlichen zu können. | ||
}} | |3=Üben}} | ||
==Salzkristalle sind zwar hart aber meist spröde und zerbrechlich == | ===Salzkristalle sind zwar hart aber meist spröde und zerbrechlich === | ||
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können: | ||
{{Box|Die meisten Salze bilden feste Kristalle, aber wenn man sie mit dem Hammer bearbeitet '''zerspringen sie recht leicht''' in kleinere Kristalle der gleichen Form. '''Kristalle sind spröde'''.}} | {{Box|Typische Eigenschaft von Salzen: Kristalle sind spörde|Die meisten Salze bilden feste Kristalle, aber wenn man sie mit dem Hammer bearbeitet '''zerspringen sie recht leicht''' in kleinere Kristalle der gleichen Form. '''Kristalle sind spröde'''.|Hervorhebung1}} | ||
| Zeile 280: | Zeile 279: | ||
''Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!'' | ''Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!'' | ||
}} | |3=Üben}} | ||
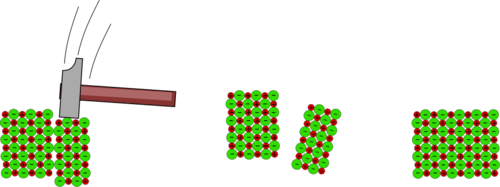
{{Box|10.2|Ordnet die folgenden Bilder, so dass sie nacheinander beschreiben, was passiert, wenn man mit einem Hammer auf ein Kristall haut. Beschreibt zu jedem Bild was jeweils passiert und begründet wenn möglich was da passiert. Ziel ist es natürlich zu erklären, warum das Kristall recht leicht zerbricht. | {{Box|10.2|2=Ordnet die folgenden Bilder, so dass sie nacheinander beschreiben, was passiert, wenn man mit einem Hammer auf ein Kristall haut. Beschreibt zu jedem Bild was jeweils passiert und begründet wenn möglich was da passiert. Ziel ist es natürlich zu erklären, warum das Kristall recht leicht zerbricht. | ||
<center>[[Datei:Sprödigkeit.svg|500px]]</center> | <center>[[Datei:Sprödigkeit.svg|500px]]</center> | ||
|3=Üben}} | |||
{{Box|10.3|2=Die zwei folgenden Bilder zeigen die Teilchen von anderen Stoffen. Sie sind ungeladen, also keine Ionen. Erkläre daran ... | |||
{{Box|10.3|Die zwei folgenden Bilder zeigen die Teilchen von anderen Stoffen. Sie sind ungeladen, also keine Ionen. Erkläre daran ... | |||
* warum manche Stoffe ohne Ionen nicht so leicht verformbar sind. | * warum manche Stoffe ohne Ionen nicht so leicht verformbar sind. | ||
* warum der Stoff beim Hauen mit dem Hammer nicht so schnell zerfällt. | * warum der Stoff beim Hauen mit dem Hammer nicht so schnell zerfällt. | ||
| Zeile 295: | Zeile 293: | ||
<center>[[Datei:Keine Sproedigkeit1.svg]] [[Datei:Keine Sproedigkeit2.svg]]</center> | <center>[[Datei:Keine Sproedigkeit1.svg]] [[Datei:Keine Sproedigkeit2.svg]]</center> | ||
Wählt dazu jeweils das passende Bild aus und begründet das mit ähnlichen Bilderfolgen wie bei der Aufgabe 10.2}} | Wählt dazu jeweils das passende Bild aus und begründet das mit ähnlichen Bilderfolgen wie bei der Aufgabe 10.2|3=Üben}} | ||
{{Box|10.4|Bereitet nun vor, wie ihr euren Mitschülern erklären wollt, wie sich Salze sprüde sind. Überlegt dazu: | {{Box|10.4|2=Bereitet nun vor, wie ihr euren Mitschülern erklären wollt, wie sich Salze sprüde sind. Überlegt dazu: | ||
* Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren? Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte! | * Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren? Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte! | ||
* Eure Mitschüler bekommen die drei Bilder mit dem Hammer und den Ionen ausgedruckt. Bereitet eine kurze Beschreibung dazu vor. | * Eure Mitschüler bekommen die drei Bilder mit dem Hammer und den Ionen ausgedruckt. Bereitet eine kurze Beschreibung dazu vor. | ||
}} | |3=Üben}} | ||
[[Kategorie:Rheinland-Pfalz]] | [[Kategorie:Rheinland-Pfalz]] | ||
[[Kategorie:Unterrichts-Seite]] | [[Kategorie:Unterrichts-Seite]] | ||
| Zeile 315: | Zeile 310: | ||
[[Kategorie:Elektronen]] | [[Kategorie:Elektronen]] | ||
[[Kategorie:Kern-Hülle-Modell]] | [[Kategorie:Kern-Hülle-Modell]] | ||
[[Kategorie:ChemieUnfertig]] | |||
[[Kategorie:Chemie]] | |||
Aktuelle Version vom 23. April 2022, 14:20 Uhr
Wir wollen versuchen die beobachteten Eigenschaften von Kochsalz - als Stellvertreter für die Gruppe der salzartigen Verbindungen - zu erklären. Anfangen werden wir dabei mit der Leitfähigkeit.
Woher kommen diese besonderen Eigenschaften von Salz bzw. den salzartigen Verbindungen? Aufgrund deines bisherigen Wissens kannst du das noch nicht erklären. Die Erklärung steckt in der Materie drin, genauer sogar im Atom drin. Daher werden wird uns auch gleich mit den Forschungen von einigen sehr bekannten Wissenschaftlern beschäftigen.
Anfangen werden wir mit einem der Experimente, nämlich der Stromleifähigkeit.
Strom wird geleitet oder eben nicht
Um zu verstehen, warum eine Salzlösung Strom leitet, aber alle anderen betrachteten Stoffe (Salz- und Zuckerkristall, Zuckerlösung, Wasser) aber nicht, müssen wir uns zuerst einmal kurz anschauen, was überhaupt Strom ist. In der grundschule und auch in NaWi wird das ja als Thema schon angesprochen.
Um zu testen, ob du das verstehst, schauen wir uns die folgende kleine Animation an, in der man sehen kann, warum eine Batterie eine Lampe zu Leuchten bringt.
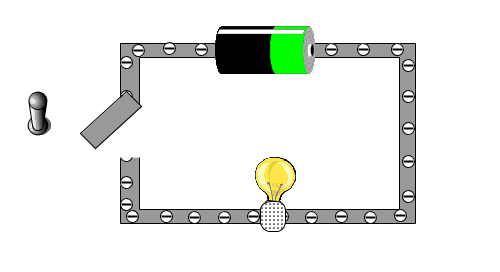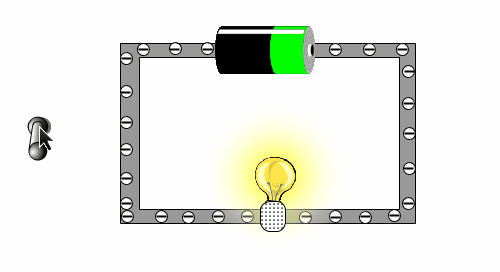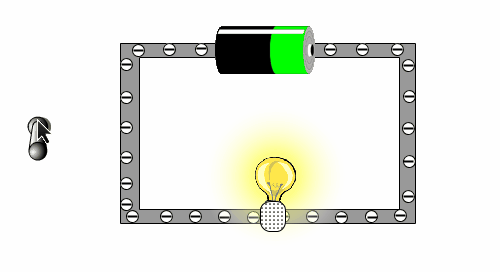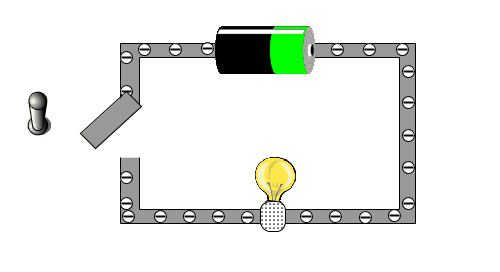
- Beschrifte das Bild mit den Begriffen: Lampe, Schalter, Batterie, Kabel
- Was bewirkt die Bewegung der Elektronen in der Glühbirne?
- Wer sorgt dafür, das sich die Elektronen bewegen wollen?
- Warum führt es dazu, dass das Licht ausgeht, wenn der Schalter betätigt wird?
- Woher kommen die Elektronen?
Das Bild soll einen einfache Stromkreislauf darstellen. Wenn der Stromkreislauf geschlossen ist, können sich die Elektronen im Kabel bewegen. Mit ihrer Bewegung bringen sie den Glühfaden in der Birne aufgrund der Reibung zum Glühen. Die Bewegung wird von der Batterie verursacht, die man als eine Art Elektronenpumpe ansehen kann. Der Schalter unterbricht das Kabel, was auch bedeutet, dass der Stromkreislauf unterbrochen ist. Die "Elektronenpumpe" kann die Elektronen nicht weiterschieben, da sie sich am Schalter stauen. Sobald der Schalter wieder geschlossen ist, können die Elektronen wieder fließen.
- WICHTIG: Man darf das Kabel nicht wie einen Schlauch und die Batterie wie einen Tank sehen, von dem aus dann die Elektronen wie Wasser in einen leeren Schlauch hineingeleitet werden. Denn wenn man ein Kabel an die Batterie anschließt, fließt der Strom gleich und man muss nicht warten, egal wie lang das Kabel ist. Der Grund dafür ist, dass in dem Kabel immer Elektronen vorhanden sind. Nur durch die Batterie werden diese Elektronen verschoben und bewegen sich dann.
Da wir davon ausgehen, dass alle Materie um uns herum nur aus Atomen besteht und nichts anderes, bleibt nur eine Folgerung übrig.
Das ist neu! Dachte wir doch bisher, dass die Atome unteilbar sind und nun sind die Elektronen ein Teil davon, die sich auch noch unabhängig von ihnen bewegen können.
Wenn wir aber davon ausgehen, dass alles um uns herum, was ja aus Atomen besteht, auch Elektronen enthält, das stellt sich doch die Frage, warum einige Stoffe den Strom leiten können, andere Stoffe aber nicht?
Auch hier gibt es zwei kleine Animationen, die dir zeigen, wo der Unterschied zwischen einem Leiter und Isolator (= Nicht-Leiter) ist.
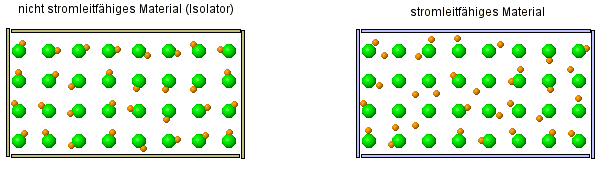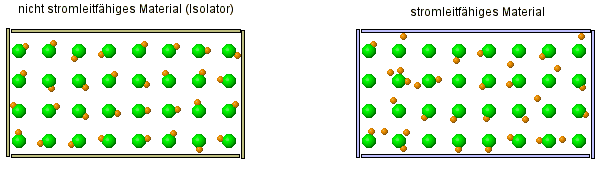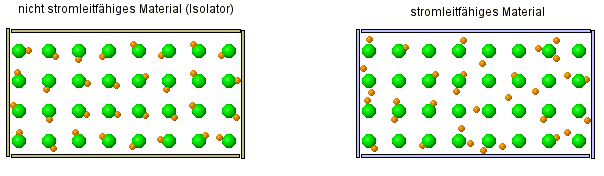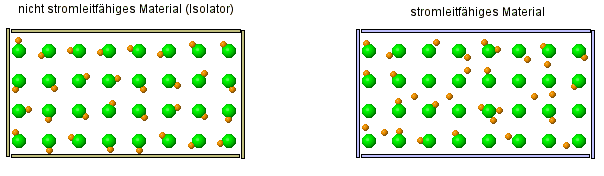
- Stelle eine Vermutung darüber auf, um was es sich bei den orangenen Kugeln und den grünen Kugeln handelt?
- Warum ist es eigentlich ein Fehler, wenn man die grünen Kugeln so weit voneinander weg zeichnet und warum macht man es trotzdem?
Was hier dargestellt werden soll, sind Atome mit eines von ihren Elektronen. Die beweglichen, orangenen Kugeln stellen dabei die Elektronen dar, die kleiner sind als der Rest des Atoms, der durch die orangene Kugel dargestellt wird. Die orangene Kugel ist als nicht das Atom selber, denn das Elektrone ist ja ein Teil davon.
Denn Abstand etwas größer zu lassen, ist sicherlich deshalb sinnvoll, weil man sonst nicht so wirklich erkennen würde, wie die Bewegung der Elektronen ist. Denn normalerweise liegen die Atome ja eng beeinander und das wäre sehr unübersichtlich.
Alle Atome enthalten Elektronen!? Warum aber sind dann aber nicht alle Stoffe auch Leiter, denn sie bestehen ja alle aus Atomen und die enthalten ja Elektronen.
- Beschreibe, wie sich die Elektronen in einem Leiter verhalten und wie sie sich von den Elektronen in einem Isolator verhalten.
Wie sich also zeigt, sind die Elektronen eine Möglichkeit wie Strom geleitet werden kann. Das ist so, wie es in der Animation dargestellt wird, tatsächlich eine Besonderheit, die typisch für Metalle ist. Da sind die Elektronen nur sehr locker an das Atom gebunden, was nicht nur zur Leitfähigkeit führt, sondern auch den metallischen Glanz bewirkt.
Da Kochsalz als Feststoff ein Isolator ist, in flüssiger Form aber den Strom leitet, muss es einen anderen Grund geben.
Daraus ergibt sich eine Tatsache, die der Vorstellung, die den Atomen ihren Namen gaben (von altgriechisch atomos = unteilbar) widerspricht!
Das Rosinenkuchenmodell
Der britische Physiker Joseph Thomson war ein britischer Physiker und Nobelpreisträger für Physik. Er entdeckte 1897 (etwa zeitgleich mit dem deutschen Physiker Emil Wiechert) das Elektron.
Thomson war Professor für Physik am Trinity College der University of Cambridge. Er soll tollpatschig gewesen sein und daher versuchten seine Assistenten und Schüler stets, ihn von den Experimenten fernzuhalten. Also überwachte Thomson nur die Experimente und gab Anweisungen.
Ab 1881 untersuchte er das Verhalten von bewegten Ladungen und setze dabei eine sogenannte Kathodenstrahl-Röhre ein. Seine Untersuchung der Kathodenstrahlung 1897 zum experimentellen Nachweis für die bereits 1874 vorhergesagte Existenz des Elektrons. Thomson konnte auch nachweisen, dass sich bewegende Elektronen durch ein Magnetfeld ablenken ließen, was von deutschen Physiker Heinrich Hertz zuvor bestritten worden war.
Kathodenstrahlröhren kann man technisch als Vorgänger der alten Fernsehen ansehen, also nicht die flachen Displays sondern die dicken und schweren Fernseher.
 Dies war die erste Entdeckung und der Nachweis eines Teilchens, das kleiner als die Atome war. Darauf basierend entwickelte Thomson das Thomsonsche Atommodell (auch „Rosinenkuchen-“ oder „Plumpudding-Modell“), wonach die sehr kleinen Elektronen Teile der Atome sind und im Inneren der Atome eingebettet seien, wie Rosinen in einem Kuchenteig.
Dies war die erste Entdeckung und der Nachweis eines Teilchens, das kleiner als die Atome war. Darauf basierend entwickelte Thomson das Thomsonsche Atommodell (auch „Rosinenkuchen-“ oder „Plumpudding-Modell“), wonach die sehr kleinen Elektronen Teile der Atome sind und im Inneren der Atome eingebettet seien, wie Rosinen in einem Kuchenteig.
Das Bild soll darstellen, wie sich Thomson sein Rosinenkuchenmodell vorstellte. Bearbeite das Bildzuordnungsquiz und versuche die Begriffe richtig zuzuordnen um damit Thomsons Idee zu verstehen. Trage nach der Kontrolle die richtigen Beschriftungen auf das ausgeteilte Arbeitsblatt ein und klebe es dann ins Heft.
- → Zum Quiz
Hast du verstanden, wie Thomson auf sein Atommodell kam? Und was es mit der Stromleitfähigkeit auf sich hat? Zur Kontrolle solltest du auf jeden Fall mal noch dieses Multiple-Choice-Quiz durchgehen.
Ernest Rutherford und das Streuexperiment
Ernest Rutherford (1871-1937 in Cambridge) war ein aus Neuseeland stammender Physiker, der zunächst als Assistent von Joseph J. Thomson in Cambridge arbeitete. Zunächst beschäftigte er sich mit der Verbesserung der Empfindlichkeit seines Detektors, mit dem er Radiowellen in einer Entfernung von etwa einer halben Meile nachweisen konnte. Thomson, der Rutherfords experimentelles Talent schnell erkannte, lud Rutherford 1896 ein, ihn bei seinen Untersuchungen der elektrischen Leitfähigkeit von Gasen zu unterstützen. Sie benutzten die wenige Monate zuvor entdeckten Röntgenstrahlen, um die Leitfähigkeit in den Gasen auszulösen.
1898 wurde Rutherford als Professor an die Universität in Montreal (Kanada) berufen, wo er bis 1907 arbeitete.
Bekannt und berühmt wurde er für das Streu-Experiment, mit der genauer in den Aufbau der Atome eindringen konnte, ohne wirklich hineinschauen zu können.
Das Kern-Hülle-Modell
Übungen zum Kern-Hülle-Modell
- Build an atom / Baue ein Atom
- Isotopes and Atommassen/Isotope und Atommassen
- Reaktionsgleichungen ausgleichen ... mit Schinken und Käse
- Schmelz- und Siedetemperaturen bei Ionen und ungeladenen Teilchen
Wieso sind die Ionen für die Leitfähigkeit der Salzlösungen notwendig? ==
Das wir uns die Ionen angeschaut haben, hatte seinen Grund. Ursprünglich hatte wir uns mit der Leitfähigkeit der Salzlösung beschäftigt bzw. was Strom und Leitfähigkeit überhaupt ist.
Wenn wir nun die Stromleitfähigkeit mit Hilfe der Ionen erklären wollen, so müssen wir folgende Dinge betrachten und daraus eine schlüssige Kette von Begründungen zusammensetzen:
- Beschreibung der Eigenschaft der Leitfähigkeit und der Hintergründe, die schon bekannt sind.
- Wie verhalten sich Ionen aufgrund ihrer Ladung und wieso spielt das hier eine Rolle?
- Wie kann man die Eigenschaft der Leitfähigkeit aufgrund der Ionen erklären?
Interessant sind die folgenden Animationen, die im Teilchenmodell zeigen, was passiert, wenn eine Salz-Lösung den Strom leitet:
Weitere Eigenschaften der Salze betrachten und erklären
Nachdem wir mit Hilfe der Ionen erklären konnten, warum Salzlösungen stromleitfähig sind, schauen wir uns noch einmal die restliche Eigenschaften an. Mit Hilfe des Buches und weiteren Medien, wie Simulationen, sollt ihr in euer Gruppe Gründe für die Eigenschaften von Salzen = Ionenverbindungen finden.
Salze sind meist wasserlöslich
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können:
Wie schon beim Thema "Leitfähigkeit" musst du wieder das Vorwissen heraussuchen, um die Eigenschaften mit Hilfe der Anwesenheit der Ionen erklären zu können. Die Eigenschaften der Ionen haben wir schon bei der Leitfähigkeit ausführlich notiert. Sucht deshalb im Buch und in anderen Quellen nach den folgenden Informationen zur Wasserlöslichkeit und sammelt sie in eurer Gruppe.
- Wie sind die Teilchen eines Stoffes im festen Zustand angeordnet?
- Warum kann man den Stoff (das Salz) als Feststoff sehen, aber im gelösten Zustand nicht mehr?
Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!
Schaut euch die Simulation an, wo man die Löslichkeit von Kochsalz und Sucralose (wobei uns die Sucralose eigentlich nicht interessiert!) vergleichen kann. Nach dem Start hat man oben drei Reiter "Macro", "Micro" und "Water": Schaut euch vor allem "Micro" und "Water" an. Simulation starten
Beantwortet die folgenden Fragen zu "Micro" wenn ihr Wasser eingelassen, Salz hinzugeben und Wasser habt verdampfen lassen (evaporation!):
- Was ist mit den Ionen, wenn das Salz in eine größere Menge an Wasser gelöst wird?
- Was passiert mit den Ionen, wenn man Wasser verdampfen lässt und warum tun sie das?
Beantwortet dann die folgenden Fragen zu "Water":
- Wie kommt es, dass die Ionen nicht mehr zusammenhalten?
Den Vorgang des Lösens kann in einer anderen Simulation besser angeschaut werden, die ihr euch als Film anschauen könnt. Beantwortet dazu folgende Fragen:
- Die Kristalle mit den Ionen ist am Anfang quasi noch trocken. Die Teilchen sind aber in Bewegung. Warum halten die Teilchen hier zusammen?
- Wenn Wasser dazu gegeben wird "greift" das Wasser den Kristall an. Wie kommt es, dass das Wasser zwischen die Ionen kommt?
- Obwohl die Ionen sich immer noch anziehen, werden die ersten Ionen aus dem Kristall abgetrennt. Wie wird verhindert, dass die Ionen nicht mehr so richtig zusammenkommen?
- Was ist die Voraussetzung dafür, dass sich das Salzkristall vollständig auflösen kann, dass heißt dass keine zwei Ionen mehr direkt nebeneinander liegen.
Eine andere Simulation vergleicht Kochsalz mit schlecht löslichen Salzen. Startet sie hier. Betrachtet nur die Reiter "Table Salt" (= Tafel-Salz = Kochsalz) und "Slightly Soluble Salts" (= schlecht löslich Salze) und beantwortet dann die Fragen:
- Was passiert, wenn man vom dem Kochsalz sehr viel ins Wasser gibt?
- Was könnte der Unterschied zwischen Kochsalz und einem schlecht löslichen Salz sein?
Bereitet nun vor, wie ihr euren Mitschülern erklären wollt, wie sich Salze in Wasser auflösen. Überlegt dazu:
- Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren. Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte!
- Überlegt welche der Simulationen ihr verwenden wollt und welche Aktionen gezeigt werden sollen, um diese Informationen verdeutlichen zu können.
Salze haben meist hohe Schmelz- und Siedetemperaturen
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können:
Wie schon beim Thema "Leitfähigkeit" müsst ihr wieder das Vorwissen heraussuchen, um die Eigenschaften mit Hilfe der Anwesenheit der Ionen erklären zu können. Die Eigenschaften der Ionen haben wir schon bei der Leitfähigkeit ausführlich notiert. Sucht deshalb im Buch und in anderen Quellen nach den folgenden Informationen zu Schmelz- und Siedetemperaturen heraus und sammelt sie in eurer Gruppe.
- Wie ist die Anordnung der kleinsten Teilchen (in diesem Fall der Ionen) im festen, flüssigen und gasförmigen Zustand?
- Wie unterscheiden sich allgemein die Teilchen von Stoffen mit hohen oder niedrigen Siedetemperaturen?
Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!
Informiert euch über die Schmelz- und Siedetemperaturen der folgenden Stoffe:
- Natriumchlorid, Calciumsulfat(Gips), Wasser, Pyrit, Methan, Ethanol (der Trinkalkohol), Calcit
Schaut euch diese Simulation hier an, startet sie mit dem Knopf ▶ unten in der Mitte, erhöht zunächst nur die Temperatur und beobachtet was passiert. Setzt die Simulation zurück mit ◀ und ändert die anderen Einstellungen. Ihr könnt die Anziehung der Teilchen ändern (attraction = Anziehung) oder den Teilchen Ladungen (Häkchen bei "charge" machen) geben, so dass sie Ionen sind. Beantwortet dann die folgenden Fragen:
- Was passiert mit den Teilchen allgemein, wenn ein Stoff erhitzt wird?
- Warum werden Stoffe, die keine geladenen Teilchen enthalten, schneller flüssig?
- Was hält stärker zusammen? Einfache Teilchen die sich anziehen oder Ionen? Vermutet warum das so ist!
In dieser Simulation können ungeladene Teilchen und Ionen direkt miteinander verglichen werden. Ihr könnt die Temperatur ändern, indem ihr die Knöpfe "heat" und "cool" drückt.
- Was ist der Unterschied zwischen den beiden Arten von Teilchen, wenn sie erhitzt werden?
- Was könnten die gestrichelten Linien andeuten?
Bereitet nun vor, wie ihr euren Mitschülern erklären wollt, das Salze hohe Schmelz- und Siedetemperaturen haben. Überlegt dazu:
- Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren. Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte!
- Überlegt welche der Simulationen ihr verwenden wollt und welche Aktionen gezeigt werden sollen, um diese Informationen verdeutlichen zu können.
Salze haben meist gerade Kanten und glatte Flächen
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können:
Wie schon beim Thema "Leitfähigkeit" musst du wieder das Vorwissen heraussuchen, um die Eigenschaften mit Hilfe der Anwesenheit der Ionen erklären zu können. Die Eigenschaften der Ionen haben wir schon bei der Leitfähigkeit ausführlich notiert. Suche deshalb im Buch und in anderen Quellen nach den folgenden Informationen zum Teilchenmodell heraus und sammele sie in deiner Gruppe.
- Wie ist die Anordnung der kleinsten Teilchen (in diesem Fall der Ionen) im festen Zustand?
Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!
Sucht im Internet und zum Beispiel auch auf der Seite Wikimedia-Commons nach verschiedenen Kristallformen (Stichwort: "crystal"). Die Kategorien "Kristalle" und "Mineralien" zeigen noch mehr Bilder. Ihr könnt natürlich auch auf Wikipedia schauen.
Sucht euch möglichst verschiedene Formen an Kristallen aus und sammelt die Bilder in einem Textdokument (Bilder nicht zu groß, damit mehrere Bilder auf eine Seite passen). Speichert das fertige Dokument auf dem Verzeichnis i: und gebt mir Bescheid, damit ich es sichern kann.Schaut euch die Simulation hier an, schaltet die Ladung = charge an (so das man Ionen hat) und stellt die Temperatur ganz hoch. Startet die Simulation, beobachtet erst, was passiert und senkt dann die Temperatur nach und nach. Macht das gleiche bei ungeladenen Teilchen, indem ihr das Häkchen bei "charge" entfernt".
Beantwortet dann die folgenden Fragen:
- Warum gehen die Ionen relativ schnell zusammen, im Vergleich zu den ungeladenen Teilchen?
- Bei den ungeladenen Teilchen sind diese eigentlich näher zusammen (auf Lücke). Warum ist die Anordnung bei den Ionen nicht genauso?
- Warum bilden sich die Kristalle erst bei niedrigeren Temperaturen?
- Wieso haben wir glatte Kanten bzw. warum sind glatte Kanten (eher) möglich? Im Gegensatz zu den ungeladenen Teilchen.
Bereitet nun vor, wie ihr euren Mitschülern erklären wollt, wie sich Salze Kristalle bilden. Überlegt dazu:
- Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren. Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte!
- Überlegt welche der Simulationen ihr verwenden wollt und welche Aktionen gezeigt werden sollen, um diese Informationen verdeutlichen zu können.
Salzkristalle sind zwar hart aber meist spröde und zerbrechlich
Du sollst in deiner Gruppe die folgende typischen Eigenschaft von Salzen erklären können:
Wie schon beim Thema "Leitfähigkeit" müsst ihrwieder das Vorwissen heraussuchen, um die Eigenschaften mit Hilfe der Anwesenheit der Ionen erklären zu können. Die Eigenschaften der Ionen haben wir schon bei der Leitfähigkeit ausführlich notiert. Sucht deshalb im Buch und in anderen Quellen nach den folgenden Informationen zum Teilchenmodell heraus und sammele sie in deiner Gruppe.
- Wie ist die Anordnung der kleinsten Teilchen (in diesem Fall der Ionen) im festen Zustand?
Sorgt dafür, dass jedes Gruppenmitglied die Infos zu Hause hat!
Die zwei folgenden Bilder zeigen die Teilchen von anderen Stoffen. Sie sind ungeladen, also keine Ionen. Erkläre daran ...
- warum manche Stoffe ohne Ionen nicht so leicht verformbar sind.
- warum der Stoff beim Hauen mit dem Hammer nicht so schnell zerfällt.


Bereitet nun vor, wie ihr euren Mitschülern erklären wollt, wie sich Salze sprüde sind. Überlegt dazu:
- Welche wichtigen Informationen sollen die Mitschüler als Begründung für die Frage ins Heft notieren? Dazu gehören auch eure eigenen Bilder/Skizzen die dann abgezeichnet werden müssen, um dies zu verdeutlichen. Bereitet das auf einem weißen Blatt Papier vor und verwendet nicht zu dünne Stifte!
- Eure Mitschüler bekommen die drei Bilder mit dem Hammer und den Ionen ausgedruckt. Bereitet eine kurze Beschreibung dazu vor.