Oberstufen-Chemiebuch Kontextorientiert/Grundlagen der Polymer-Chemie: Unterschied zwischen den Versionen
KKeine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
|||
| (21 dazwischenliegende Versionen von 4 Benutzern werden nicht angezeigt) | |||
| Zeile 78: | Zeile 78: | ||
An dieses Ausgangsradikal lagern sich nun in einer ''Wachstumsreaktion'', ohne das eine weitere Zufuhr von Aktivierunsenergie notwendig ist, ständig mehr Monomere an. Dabei findet, wie bei der Startreaktion, durch den Angriff des | An dieses Ausgangsradikal lagern sich nun in einer ''Wachstumsreaktion'', ohne das eine weitere Zufuhr von Aktivierunsenergie notwendig ist, ständig mehr Monomere an. Dabei findet, wie bei der Startreaktion, durch den Angriff des readikalischen Kohlenstoff-Atoms an ein Monomer, bei diesem immer eine Spaltung der Doppelbindung und Umlagerung der einzelnen Elektronen statt. Diese Reaktion kann theoretisch immer so weiter ablaufen, bis schließlich das Monomer aufgebraucht ist. | ||
:[[Datei:RadikalischeKettenpolymerisation Wachstum.svg|rahmenlos|hochkant=3.1|Mechanismus der Wachstumsreaktion bei einer radikalischen Kettenpolymerisation]] | :[[Datei:RadikalischeKettenpolymerisation Wachstum.svg|rahmenlos|hochkant=3.1|Mechanismus der Wachstumsreaktion bei einer radikalischen Kettenpolymerisation]] | ||
| Zeile 96: | Zeile 96: | ||
Wie lang die Ketten werden, hängt im wesentlichen nicht davon ab, wieviel des Monomers man zur Verfügung stellt. Man kann die Kettenlänge aber steuern und das sollte leicht erklärbar sein. | Wie lang die Ketten werden, hängt im wesentlichen nicht davon ab, wieviel des Monomers man zur Verfügung stellt. Man kann die Kettenlänge aber steuern und das sollte leicht erklärbar sein. | ||
{{ | {{Box|Aufgabe 1|Die Kettenlänge der Makromoleküle ist niemals bei allen Molekülen identisch. Allerdings kann man die durchschnittliche Länge der Ketten steuern, indem man die Menge an Radikal-Starter variiert. Daher die Frage: | ||
* Wie wirkt sich die Zugabe einer größeren Menge an Radikalstarter auf die durchschittliche Kettenlänge der Makromoleküle aus? Werden sie länger oder kürzer? | * Wie wirkt sich die Zugabe einer größeren Menge an Radikalstarter auf die durchschittliche Kettenlänge der Makromoleküle aus? Werden sie länger oder kürzer? | ||
Begründe | Begründe deine Antwort!|Üben}} | ||
Es gibt auch sogenannte Kettenüberträger, die gezielt zu bestimmten Zeitpunkten der Polymerisation zugegeben werden, um das aktive Zentrum einer wachsenden Polymerkette auf ein anderes Molekül zu übertragen. | Es gibt auch sogenannte Kettenüberträger, die gezielt zu bestimmten Zeitpunkten der Polymerisation zugegeben werden, um das aktive Zentrum einer wachsenden Polymerkette auf ein anderes Molekül zu übertragen. | ||
| Zeile 114: | Zeile 114: | ||
{{ | {{Box|Aufgabe 2|Polyethylen wird aus dem Monomer Ethylen bzw. Ethen gebildet. Zeichne eine Polymerkette, die aus 5 Monomeren gebildet wird. | ||
{{ | {{Lösung versteckt|{{Box|LÖSUNG - AUFGABE 2|2= | ||
'''PVC''' (= Polyvinychlorid) ist das drittwichtigste Polymer und ist besonders beständig gegen Sonnenlicht und andere Witterungseinflüsse. Es wird aus dem Monomer CH<sub>2</sub>=CHCl gebildet. | <center>[[Datei:PE-Polymer aus 5 Monomeren.svg|500px]]</center> | ||
* Zeichne eine Polymerkette, die 4 | |3=Lösung}}}}|Üben | ||
}} | |||
{{Box|Aufgabe 3 | |||
| 2 = a.) '''PVC''' (= Polyvinychlorid) ist das drittwichtigste Polymer und ist besonders beständig gegen Sonnenlicht und andere Witterungseinflüsse. Es wird aus dem Monomer CH<sub>2</sub>=CHCl gebildet. | |||
* Zeichne eine Polymerkette, die 4 Repetiereinheiten enthält und schreibe das Polymer kurz mit Hilfe der Repetiereinheit. | |||
* Gib den Namen des Monomers an. | * Gib den Namen des Monomers an. | ||
::'''''TIPP:''' Schreibe das Monomer erst einmal in die Lewisschreibweise um, statt in der | ::'''''TIPP:''' Schreibe das Monomer erst einmal in die Lewisschreibweise um, statt in der gegebenen Halbstrukturschreibweise.'' | ||
{{Lösung versteckt|{{Box|LÖSUNG - AUFGABE 3a|2= | |||
<center>[[Datei:PVC Monomer Polymer.png|500x500px]]</center>|3=Lösung}}}} | |||
[[Datei:Acrylamid.svg|right|150px]] | [[Datei:Acrylamid.svg|right|150px]] | ||
Das Monomer '''Acrylamid''' ''(siehe rechts)'' bildet wasserlösliche Polymerketten. Es wird auch für die Herstellung von Superabsorbern in Windeln genutzt. | b.) Das Monomer '''Acrylamid''' ''(siehe rechts)'' bildet wasserlösliche Polymerketten. Es wird auch für die Herstellung von Superabsorbern in Windeln genutzt. | ||
* Zeichne zunächst das Monomer in Lewisschreibweise so, dass die Doppelbindung | * Zeichne zunächst das Monomer in Lewisschreibweise so, dass die Doppelbindung waagerecht "liegt" und die andere Atome entsprechend daran hängen. | ||
* Zeichne eine Polymerkette, die 4 | * Zeichne eine Polymerkette, die 4 Repetiereinheiten enthält und schreibe das Polymer kurz mit Hilfe der Repetiereinheit. | ||
* Wie ist der Name des | * Wie ist der Name des Polymers? | ||
{{Lösung versteckt|{{Box|LÖSUNG - AUFGABE 3b|2=|3=Lösung}}}} | |||
<center></center> | |||
| 3 = Üben | |||
}} | }} | ||
{{ | {{Box|Aufgabe 4|Schreibe die angegebenen Poylmerketten mit Hilfe einer Repetiereinheit auf und bestimme das Monomer dazu. | ||
* Schreibe zuerst die angegebene Skelettschreibweise um, in die Lewisschreibweise (zumindest alle C-Atome aufschreiben) und zeichne die Hauptkette gerade/waagrecht ein. | |||
* Markiere dann die Repetiereinheit! | |||
<center>[[Datei:PMMA-chain.png|300px]]</center> | |||
=== Einsatz von Katalysatoren === | {{Lösung versteckt|{{Box|LÖSUNG - AUFGABE 4|2= | ||
[[Datei:Gemischte Aufgabenstellungen zu den Polymeren Lösung PMMA.svg|500px]] | |||
|3=Lösung}}}} | |||
| 3 = Üben | |||
}} | |||
{{Box|Aufgabe 5|Hier ist der Ausschnitt eines Co-Polymers zu sehen. Bestimme die Repetiereinheit und daraus die zwei Monomere. Gib deren Namen an. | |||
{{Lösung versteckt|{{Box|LÖSUNG - AUFGABE 5|2= | |||
<center>[[Datei:Gemischte Aufgabenstellungen zu den Polymeren Lösung Copolymer Buten und Propen 01.svg|500px]]</center> | |||
|3=Lösung}}}} | |||
| 3 = Üben | |||
}} | |||
{{Box|Aufgabe 6|Zu den zwei gegebenen Monomere soll die Polymerkette eines alternierenden Co-Polymers gezeichnet werden. | |||
{{Lösung versteckt|{{Box|LÖSUNG - AUFGABE 6|2=|3=Lösung}}}} | |||
| 3 = Üben | |||
}} | |||
===Einsatz von Katalysatoren=== | |||
Von der Definition her, sind Katalysatoren sicherlich bekannt unter der folgenden Definition: | Von der Definition her, sind Katalysatoren sicherlich bekannt unter der folgenden Definition: | ||
{{ | {{Box|Katalysator|Als Katalysator bezeichnet man in der Chemie einen Stoff, der die Reaktionsgeschwindigkeit durch die Senkung der Aktivierungsenergie einer chemischen Reaktion erhöht, ohne dabei selbst verbraucht zu werden.|Hervorhebung1 | ||
}} | |||
Bei der Herstellung von Kunststoffen haben Katalysatoren üblicherweise zwei mögliche Einsatzgebiete: | Bei der Herstellung von Kunststoffen haben Katalysatoren üblicherweise zwei mögliche Einsatzgebiete: | ||
* Durch die '''Senkung der Aktivierungsenergie''' kann die Polymerisation schon bei Normal-Temperatur stattfinden. Das führte zum Beispiel beim Polyethylen dazu, das man statt dem bisher bei hohen Temperatur erzeugten Polyethylen mit vielen größeren Seitenketten, mit Hilfe des '''Ziegler-Natta-Katalysators''' bei Raumtemperaturen ein nahezu ganz lineares Molekül erzeugen konnte. | *Durch die '''Senkung der Aktivierungsenergie''' kann die Polymerisation schon bei Normal-Temperatur stattfinden. Das führte zum Beispiel beim Polyethylen dazu, das man statt dem bisher bei hohen Temperatur erzeugten Polyethylen mit vielen größeren Seitenketten, mit Hilfe des '''Ziegler-Natta-Katalysators''' bei Raumtemperaturen ein nahezu ganz lineares Molekül erzeugen konnte. | ||
:Der Katalysator hält das "Ende" der Polymerkette und ebenso ein Monomer "fest", aktiviert sie bringt sie so in Kontakt und erleichtert so die Reaktion. | :Der Katalysator hält das "Ende" der Polymerkette und ebenso ein Monomer "fest", aktiviert sie bringt sie so in Kontakt und erleichtert so die Reaktion. | ||
<center>[[Datei:Ziegler-Natta-Mechanismus.svg]]</center> | <center>[[Datei:Ziegler-Natta-Mechanismus.svg]]</center> | ||
* Ist das Monomer unsymmetrisch können die Seitenketten der einzelnen Monomere räumlich unterschiedlich an der langen Kette hängen. Diese als '''Taktizität''' bezeichnete Eigenschaft des Molekül-Aufbaus hat eine durchaus große Auswirkung auf die Eigenschaften des Polymers. Das folgende Bild zeigt drei Varianten der Taktizität. | *Ist das Monomer unsymmetrisch können die Seitenketten der einzelnen Monomere räumlich unterschiedlich an der langen Kette hängen. Diese als '''Taktizität''' bezeichnete Eigenschaft des Molekül-Aufbaus hat eine durchaus große Auswirkung auf die Eigenschaften des Polymers. Das folgende Bild zeigt drei Varianten der Taktizität. | ||
<center>[[Datei:Polystyrol-ais.jpg]]</center> | <center>[[Datei:Polystyrol-ais.jpg]]</center> | ||
| Zeile 152: | Zeile 185: | ||
:Der Katalysator sorgt nicht nur für eine vereinfachte Reaktion, sondern bewirkt auch eine regelmäßige Anordnung der Seitenketten, da die Monomere immer von der gleichen Seite an die Kette angefügt werden. | :Der Katalysator sorgt nicht nur für eine vereinfachte Reaktion, sondern bewirkt auch eine regelmäßige Anordnung der Seitenketten, da die Monomere immer von der gleichen Seite an die Kette angefügt werden. | ||
=== Versuch: Herstellung von Plexiglas === | ===Versuch: Herstellung von Plexiglas === | ||
Polymethylmethacrylat oder kurz PMMA ist auch unter dem Namen Acrylglas bekannt. Vom Chemiker Otto Röhm aus Darmstadt ''(heute die Firma Evonik/Röhm'') wurde es 1933 unter dem Namen '''Plexiglas''' als Patent angemeldet. In der DDR verwendete man die Bezeichnung O-Glas (für „organisches Glas“). | Polymethylmethacrylat oder kurz PMMA ist auch unter dem Namen Acrylglas bekannt. Vom Chemiker Otto Röhm aus Darmstadt ''(heute die Firma Evonik/Röhm'') wurde es 1933 unter dem Namen '''Plexiglas''' als Patent angemeldet. In der DDR verwendete man die Bezeichnung O-Glas (für „organisches Glas“). | ||
| Zeile 164: | Zeile 197: | ||
{{Box | |||
| | {{Box|EXPERIMENT Herstellung von Plexiglas|'''Material:''' {{Sicherheitsinfo|Schutzbrille|GHSBrennbar|GHSGesundheitsgefahr|GHSExplosiv}} | ||
| | |||
{{Sicherheitsinfo|Schutzbrille|GHSBrennbar|GHSGesundheitsgefahr|GHSExplosiv}} | |||
* Reagenzglas | * Reagenzglas | ||
* Becherglas mit Wasser auf Heizplatte | * Becherglas mit Wasser auf Heizplatte | ||
| Zeile 176: | Zeile 206: | ||
'''Durchführung:''' | '''Durchführung:''' | ||
# In das Reagenzglas werden etwa 5 ml Methacrylsäuremethylester und 2 Spatelspitzen Dibenzoylperoxid gegeben. | |||
Die Lösung wird im Wasserbad erwärmt. Sobald man eine Reaktion zu beobachten kann, wird das | # Die Lösung wird im Wasserbad erwärmt. Sobald man eine Reaktion zu beobachten kann, wird das Reagenzglas aus dem Wasserbad herausgenommen und die Masse auf die Alufolie ausgegossen und man wartet, bis sich das Material verfestigt hat. | ||
Reagenzglas aus dem Wasserbad herausgenommen und die Masse auf die Alufolie ausgegossen und man wartet, bis sich das Material verfestigt hat. | |||
'''Entsorgung:''' | '''Entsorgung:''' | ||
:Das Reagenzglas kann nach dem Abkühlen in den Restmüll entsorgt werden. | :Das Reagenzglas kann nach dem Abkühlen in den Restmüll entsorgt werden.|Experimentieren | ||
| | |||
}} | }} | ||
== Die Struktur der Polymere == | ==Die Struktur der Polymere== | ||
Ein sehr großen Einfluss auf die Eigenschaften des Polymers hat die Grundstruktur des Makromoleküls. Auch bei gleichem Monomer gibt es dabei verschiedene Varianten- | Ein sehr großen Einfluss auf die Eigenschaften des Polymers hat die Grundstruktur des Makromoleküls. Auch bei gleichem Monomer gibt es dabei verschiedene Varianten- | ||
* Es können sich '''lineare Makromoleküle''' bilden, die nur aus einer Polymerkette bestehen. Im Fall von '''Polyethylen''' z.B. ist die Hauptkette ein langkettiges, unverzweigtes Alkan. | *Es können sich '''lineare Makromoleküle''' bilden, die nur aus einer Polymerkette bestehen. Im Fall von '''Polyethylen''' z.B. ist die Hauptkette ein langkettiges, unverzweigtes Alkan. | ||
* Bei entsprechenden Reaktionsbedingungen bilden sich auch '''verzweigte Makromoleküle''' mit einer Hauptkette und Seitenketten, bei verzweigtem Polyethylen wären es dann Alkylreste. | *Bei entsprechenden Reaktionsbedingungen bilden sich auch '''verzweigte Makromoleküle''' mit einer Hauptkette und Seitenketten, bei verzweigtem Polyethylen wären es dann Alkylreste. | ||
Neben der Kettenlänge bestimmt auch der '''Verzweigungsgrad''' Dichte, Festigkeit und Schmelzpunkt des Polymers. Je nach Anordnung der verschiedenen Molekülketten im Material kann es zu unterschiedlich starken Wechselwirkungen dazwischen kommen. Wenn nicht polare Gruppierungen enthalten sind, spielen nur die Van-der-Waals-Kräfte dabei eine Rolle. | Neben der Kettenlänge bestimmt auch der '''Verzweigungsgrad''' Dichte, Festigkeit und Schmelzpunkt des Polymers. Je nach Anordnung der verschiedenen Molekülketten im Material kann es zu unterschiedlich starken Wechselwirkungen dazwischen kommen. Wenn nicht polare Gruppierungen enthalten sind, spielen nur die Van-der-Waals-Kräfte dabei eine Rolle. | ||
| Zeile 197: | Zeile 225: | ||
<center> | <center> | ||
<gallery widths= | <gallery widths="190" heights="170"> | ||
Datei:Polymerstruktur-linear.svg|lineares, unverzweigtes Makromolekül | Datei:Polymerstruktur-linear.svg|lineares, unverzweigtes Makromolekül | ||
Datei:Polymerstruktur-verzweigt.svg|verzweigtes Makromolekül | Datei:Polymerstruktur-verzweigt.svg|verzweigtes Makromolekül | ||
| Zeile 207: | Zeile 235: | ||
</center> | </center> | ||
=== Einteilung in Thermoplasten, Elastomere und Duroplasten === | ===Einteilung in Thermoplasten, Elastomere und Duroplasten=== | ||
Grob werden alle Polymere in drei Gruppen eingeteilt, mit denen ihre grundlegenden Eigenschaften beschrieben werden. | Grob werden alle Polymere in drei Gruppen eingeteilt, mit denen ihre grundlegenden Eigenschaften beschrieben werden. | ||
| Zeile 247: | Zeile 275: | ||
==== Teilkristalline Polymere ==== | {{Box|Aufgabe 7|'''Informiere dich über die Wiederverwertbarkeit/Recycling der verschiedenen Arten von Kunststoffen.''' Einige Informationen, die wichtig dafür sind, solltest du schon aus den Texten bekommen haben. Informiere dich zum Beispiel über die Möglichkeit, ob und wie man Elastomere dauerhaft in eine neue Form bringen kann. Begründe deine Antworten ausführlich, mit ganzen Sätzen.|Üben | ||
}} | |||
====Teilkristalline Polymere==== | |||
[[Datei:Polymerstruktur-teilkristallin.svg|right]] | [[Datei:Polymerstruktur-teilkristallin.svg|right]] | ||
Bei thermoplastischen Polymeren gibt es noch zwei Untervarianten. Denn auch wenn es keine Atombindungen zwischen den Makromolekülen gibt, so können sie sich doch stark anziehen, dass sich strukturierte Bereiche, mit parallel liegenden Ketten, bilden. Ist das der Fall, so hat man ein '''teilkristallines''' Polymer. Dem gegenüber stehen die '''amorphen''' Polymere, also solche, bei denen die Makromoleküle einfach ungeordnet durcheinander liegen. Das entspricht einem normalen Thermoplast. | Bei thermoplastischen Polymeren gibt es noch zwei Untervarianten. Denn auch wenn es keine Atombindungen zwischen den Makromolekülen gibt, so können sie sich doch stark anziehen, dass sich strukturierte Bereiche, mit parallel liegenden Ketten, bilden. Ist das der Fall, so hat man ein '''teilkristallines''' Polymer. Dem gegenüber stehen die '''amorphen''' Polymere, also solche, bei denen die Makromoleküle einfach ungeordnet durcheinander liegen. Das entspricht einem normalen Thermoplast. | ||
| Zeile 257: | Zeile 287: | ||
Die Entstehung von teilkristalline Bereichen hängt entweder von der Verarbeitung ab oder vom Molekülbau. Bei der Verarbeitung werden zum Beispiel für Fasern durch Verstreckung (''also langziehen'') die Molekülketten zum Teil parallel angeordnet. Beim Molekülbau können stark polare Seitenketten eine starke Anziehung bewirken, die dann zu einer parallelen Anordnung der Ketten führt. | Die Entstehung von teilkristalline Bereichen hängt entweder von der Verarbeitung ab oder vom Molekülbau. Bei der Verarbeitung werden zum Beispiel für Fasern durch Verstreckung (''also langziehen'') die Molekülketten zum Teil parallel angeordnet. Beim Molekülbau können stark polare Seitenketten eine starke Anziehung bewirken, die dann zu einer parallelen Anordnung der Ketten führt. | ||
=== Transparenz von Kunststoffen === | ===Transparenz von Kunststoffen=== | ||
Zu Beginn klären wir kurz zwei wichtige Begriffe: | |||
{{Box|HINWEIS: Transparent und Opak|Ein Stoff ist '''transparent''', wenn er durchscheinend ist. | |||
Ein Stoff ist ist '''opak''', wenn er nicht durchscheinend ist.|Hervorhebung1 | |||
}} | |||
Ein bekannter transparenter Stoff ist Glas. Gewöhnlich wird Glas durch Schmelzen erzeugt. Physikalisch wird Glas als gefrorene, unterkühlte Flüssigkeit bezeichnet, die sehr schnell abgekühlt wurde. Das bedeutet, dass sich bei der Erstarrung der Schmelze zum Glas zwar Kristallkeime bilden, für eine vollständige Kristallisation jedoch nicht genügend Zeit bleibt. Das erstarrende Glas ist zu schnell fest, um noch eine Umordnung der Bausteine zu einem regelmäßig angeordneten Kristall zu erlauben. Vereinfachend entspricht somit der atomare Aufbau eines Glases in etwa dem einer Flüssigkeit. Glas ist daher eine amorphe Substanz, d.h. man hat keine geordnete Struktur. | |||
<div class="grid"> | |||
<div class="width-1-2">Damit ein Stoff transparent sein kann, müssen Lichtstrahlen, ohne gebrochen zu werden, durch den Stoff hindurch kommen können. Nur dann ist ein "Bild" erkennbar. | |||
Denn wenn die Lichtstrahlen zwar durchkommen, aber nicht in geordneter Form, weil sich ihre Richtung chaotisch ändert, dann kann man vielleicht Helligkeitsunterschiede erkennen, aber nicht was genau dort zu sehen sein müsste.</div> | |||
<div class="width-1-2">[[Datei:Fénytörés.jpg|400px]]</div> | |||
</div> | |||
Ein bekannter transparenter Stoff ist Glas. Gewöhnlich wird Glas durch Schmelzen erzeugt. Physikalisch wird Glas als gefrorene, unterkühlte Flüssigkeit bezeichnet, die sehr schnell abgekühlt wurde. Das bedeutet, dass sich bei der Erstarrung der Schmelze zum Glas zwar Kristallkeime bilden, für eine vollständige Kristallisation jedoch nicht genügend Zeit bleibt. | |||
Das erstarrende Glas ist zu schnell fest, um noch eine Umordnung der Bausteine zu einem regelmäßig angeordneten Kristall zu erlauben. Vereinfachend entspricht somit der atomare Aufbau eines Glases in etwa dem einer Flüssigkeit. Glas ist daher eine amorphe Substanz, d.h. man hat keine geordnete Struktur. | |||
<center> | <center> | ||
<gallery heights=300 widths=300> | <gallery heights="300" widths="300" style="text-align:center"> | ||
File:Piasek kwarcowy.jpg|Eines der Rohstoffe zur Glasgewinnung, Quarzsand SiO<sub>2</sub> | File:Piasek kwarcowy.jpg|Eines der Rohstoffe zur Glasgewinnung, Quarzsand SiO<sub>2</sub> | ||
Datei:Calcite.jpg|Das Mineral Calcit ist zwar transparent, aber durch eine doppelte Brechung an den Grenzflächen erscheint das Bild dahinter doppelt. | Datei:Calcite.jpg|Das Mineral Calcit ist zwar transparent, aber durch eine doppelte Brechung an den Grenzflächen erscheint das Bild dahinter doppelt. | ||
| Zeile 269: | Zeile 314: | ||
</center> | </center> | ||
Damit ein Polymer transparent ist, müssen wir also ähnliche Bedingungen wie im Glas haben, nämlich dass wir eine möglichst ungeordnete Struktur haben. Daher können nur amorphe Polymere transparent sein. Umgekehrt führen teilkristalline Bereiche dazu, dass ein Polymer nicht transparent ist. Als Begründung sollen die zwei folgenden Bilder dienen: | |||
<center> | <center> | ||
<gallery heights=300 widths=300> | <gallery heights="300" widths="300" style="text-align:center"> | ||
File:Polymerstruktur-teilkristallin mit Lichteinfall.svg|Im Bereich der Kristallite existieren Strukturen, die Lichtstrahlen reflektieren können können. Dies führt dazu, dass das Licht, wenn, dann nur gestreut, das Material durchdringen | File:Polymerstruktur-teilkristallin mit Lichteinfall.svg|Im Bereich der Kristallite existieren Strukturen, die Lichtstrahlen reflektieren können können. Dies führt dazu, dass das Licht, wenn, dann nur gestreut, das Material durchdringen kann. | ||
File:Polymerstruktur-amorph mit Lichteinfall.svg|Eine amorphe Anordnung bietet keine Stellen, an denen Lichtstrahlen reflektiert werden können | File:Polymerstruktur-amorph mit Lichteinfall.svg|Eine amorphe Anordnung bietet keine Stellen, an denen Lichtstrahlen reflektiert werden können. | ||
</gallery> | </gallery> | ||
</center> | </center> | ||
<div class="grid"> | |||
<div class="width-1-2">So ist es nicht unbedingt die Art der Monomere, die bestimmt, ob ein Poylmere transparent ist oder nicht, sondern vor allem von der Anordnung der Polymerketten untereinander. | |||
Im Bild sieht man eine Probe von PET (Polyethylenterephthalat), dass man vor allem von Kunststoffflaschen kennt. Normalerweise transparent (''also amorph'') kann kruzfristiges Erhitzen an einer Stelle dazu führen dass dort ein Kristiallisationsprozess einsetzt, der bewirkt, dass PET nicht mehr transparent ist. | |||
Ein weiterer Grund dafür, dass teilkristalline Polymere nicht transparent sind ist, dass die zwischen den kristallinen Bereichen liegenden amorphen Gebieten eine andere optische Dichte haben als, die ebenfalls zu einer Brechnung des Lichtstrahl führt. | |||
</div> | |||
<div class="width-1-2">[[File:Pet plastic crystallisation.jpg]]</div></div> | |||
Typisch an transparenten Kunststoffen ist, dass ist meist Monomere mit sehr große und starre Seitenketten haben oder selber sehr groß sind. Dies kann dazu beitragen, dass die Anordnung der Ketten eher Dazu als Beispiel zwei Kunststoffe, die meist aufgrund ihrer Transparenz genutzt werden. | |||
<gallery heights="300" widths="300" style="text-align:center"> | |||
File:Polystyrene linear.svg|'''Polystrol (PS)''' hat als Seitengruppe einen großen Benzolring. Die tatsächliche Anordnung der Kette und der Seitengruppen ist natürlich in Realität etwas anders. | |||
Datei:Isotactic-polystyrene-chain-from-xtal-3D-balls.png|Die Benzolringe versuchen sich untereinander aus dem Weg zu gehen. Im Idealfall kann das ganz regelmäßig werden, aber nur wenn das Material langsam abkühlt. | |||
Datei:Isotactic-polystyrene-chain-from-xtal-3D-vdW.png|Hier sieht man noch einmal im Kalottenmodell, wie viel Platz die Benzolringe einnehmen. | |||
File:PET.svg|Das '''Polyethylenterephthalat (PET)''' hat eine Repetiereinheit, die aufgrund von vielen Benzol-Ringen recht unflexibel ist. | |||
</gallery> | |||
[[Kategorie:Kunststoffe]] | [[Kategorie:Kunststoffe]] | ||
[[Kategorie:Organische Chemie]] | [[Kategorie:Organische Chemie]] | ||
[[Kategorie:Chemie]] | |||
Aktuelle Version vom 22. Oktober 2024, 12:48 Uhr
Diese Seite ist sehr theorielastig. Es geht hier darum, die Grundprinzipien der Polymerchemie zu verstehen. Dazu werden die Grundbegriffe relativ knapp und kompakt eingeführt. Anhand von Beispielen mit alltäglichen Kunststoffen werden dann diese Grundbegriffe aber genauer erläutert und vertieft. Ein wichtiger Aspekt, der hier eine Rolle spielt ist die Auswirkung der inneren Struktur und der Aufbau des Makromoleküls und die Auswirkung auf die Eigenschaften des Werkstoffs, den wir in der Nutzung und Untersuchung erleben.
Grundbegriff Polymer
Ein Polymer (von griechisch πολύ poly ‚viel‘ und μέρος méros ‚Teil‘) ist ein chemischer Stoff, der aus Makromolekülen besteht. Die Makromoleküle eines Stoffes sind aus einer oder mehreren Struktureinheiten, den sogenannten Repetiereinheiten oder Wiederholeinheiten, aufgebaut.
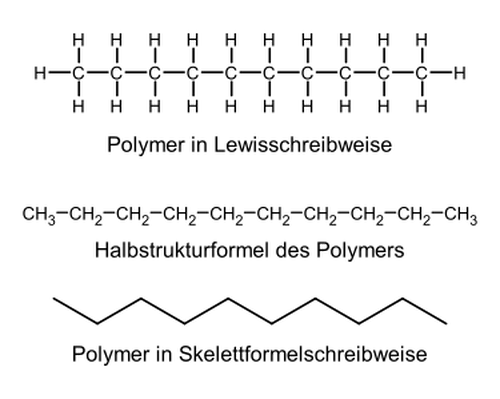
Als Beispiel sei das Polypropylen betrachtet:

|

|
| Repetiereinheit des Polypropylen | Polymerkette des Polypropylens: man erkennt an der Hauptkette anhängen Seitenketten (hier: Methyl-Gruppen), die auch in der Reptiereinheit zu sehen sind. |
Das Adjektiv polymer bedeutet dementsprechend „aus vielen (gleichen) Teilen aufgebaut“.
Ein Polymer besteht nie aus identischen Makromolekülen, da die Anzahl der Wiederholeinheiten und damit die Molekülmasse der Moleküle variiert.
Einteilung der Polymere aufgrund der Repetiereinheiten
Die Repetiereinheiten der Polymere entstehen aus den der Verknüpfung von Monomeren. Monomere sind relativ kleine, reaktionsfähige Moleküle, die sich zu den Polymeren zusammenschließen können. Die Bildung von Polymeren aus einzelnen Monomeren erfolgt dabei über verschiedene Arten von sogenannten Polyreaktionen, wie die Polymerisation, Polykondensation oder Polyaddition.
Polymere können nach der Anzahl der Monomere, aus denen sie aufgebaut sind, eingeteilt werden:
- Homopolymere bestehen aus nur einer Monomerart wie das bei den wichtigen Polymeren wie Polyethylen, Polypropylen und Polyvinylchlorid. Ein natürliches Homopolymer ist Naturkautschuk als ein Polyisopren.
- Copolymere sind aus verschiedenen Monomeren aufgebaut, wie Acrylnitril-Butadien-Styrol-Copolymer (ABS), Styrol-Acrylnitril (SAN) oder Butylkautschuk. Die meisten Biopolymere sind Copolymere. Bei Copolymeren lässt sich über Syntheseweg die Anordnung der Repetiereinheiten recht genau festlegen, was zur Einteilung der Copolymere in verschiedene Typen führt.
Statistisches Copolymer |
Gradientcopolymer |
 Pfropfcopolymer |
Alternierendes Copolymer |
Blockcopolymer |
- Polymerblends entstehen durch Mischen von unterschiedlichen Homopolymere und/oder Copolymeren. Hergestellt werden sie meist durch intensive mechanische Vermischung von geschmolzenen Polymeren, wobei sich ein homogenes Material ergibt.
| Beispiele Homo- und Copolymere und ihre Repetiereinheiten | |||
| Homopolymer Polystyrol: Eine Repetiereinheit, die sich n-fach im Makromolekül wiederholt. | Homopolymer Polydimethylsiloxan, ein Silikon. Die Hauptkette wird von Silicium- und Sauerstoffatomen gebildet. | Copolymer Styrol-Butadien-Kautschuk: Die Monomeren Styrol und 1,3-Butadien bilden zwei Repetiereinheiten, die sich nach der Abbildung in beliebiger Reihenfolge in einem Makromolekül abwechseln können. | Polyethylenterephthalat hat nur eine charakteristische Repetiereinheit, obwohl zur Synthese zwei Monomere eingesetzt werden müssen. |
Herstellung von Polymeren - die radikalische Polymerisation
Das Grundprinzip aller Herstellungsverfahren künstlichen Polymere ist die Herstellung eines Makromoleküls aus den Monomeren.
Die einfachste Variante ist die Polymerisation, international üblicherweise auch Kettenpolymerisation genannt. Es bezeichnet alle chemischen Reaktionen, bei denen sich fortlaufend gleiche oder unterschiedliche Monomere an ein wachsendes Polymer zusammensetzen. Dabei findet weder eine Abspaltung von Nebenprodukten, noch eine Wanderung von Molekülgruppen innerhalb der Reaktionspartner statt. Keine Kettenpolymerisationen sind Polykondensationen (Abspaltung von kleinen Molekülen) und Polyadditionen (Umgruppierung).
Alle Arten von Polymerisationen beruhen im Wesentlichen auf drei Teilschritten:
- Einer Startreaktion, bei der sich ein sogenanntes aktives Zentrum bildet, das der Ausgangspunkt für die Bildung des Makromoleküls ist.
- Die Wachstumsreaktion, bei der die makromolekulare Kette durch wiederholte Anlagerung der Monomere immer länger wird. Dabei findet jedes Mal die gleiche Reaktion statt, wobei das aktive Zentrum sich in jedem Schritt an das bisherige "Ende" des Makromoleküls "verschiebt".
- Die Abbruchreaktion, bei der das Wachstum der Kette durch verschiedene mögliche Reaktion beendet wird. Je nach Art des aktiven Zentrums sind verschiedene Abbruchreaktionen möglich.
Je nach Art der Startreaktion und der Art des aktiven Zentrums unterscheidet man zwischen radikalischer, kationischer und anionischer Polymerisationen. Wir betrachten nur einen Typ davon. Der Ablauf bei den anderen ist fast identisch.
Der Mechanismus der radikalischen Polymerisation
Unter einem Reaktionsmechanismus versteht man in der Chemie einen Prozess, der von den Edukten bis zum zu den Produkten immer ähnlich verläuft und bei dem Zwischenprodukte und Übergangszustände eindeutig definiert werden können. Dabei ist der Verlauf unabhängig vom genauen Ausgangsstoff sondern hängt nur davon ab, das bestimmte Bedingungen erfüllt sind. Meist sind das bestimmte Gruppierungen im Edukt oder zugesetzte Hilfschemikalien. Bei diesen Mechanismen spielen fast immer Elektronenbewegungen eine Rolle. Die Verschiebung und Umlagerung von einzelnen Elektronen oder Elektronenpaaren werden meist mit geschwungenen Pfeilen (↷) angedeutet (siehe auch rechts!).
Zum Kettenstart der Polymerisation wird ein Starter zugegeben, der sehr instabil ist und in zwei Radikale zerfällt. Ein solches Radikal greift die Mehrfachbindung an, indem das Elektronenpaar der Doppelbindung aufgespalten wird. Das Radikal R bindet sich mit Hilfe eines der Elektronen der Doppelbindung an das eine Kohlenstoff-Atom und dabei bleibt am zweiten Kohlenstoff-Atom der Doppelbindung ein einzelnes Elektron zurück. Dieses zweite Kohlenstoff-Atom ist damit nun selber ein Radikal.
An dieses Ausgangsradikal lagern sich nun in einer Wachstumsreaktion, ohne das eine weitere Zufuhr von Aktivierunsenergie notwendig ist, ständig mehr Monomere an. Dabei findet, wie bei der Startreaktion, durch den Angriff des readikalischen Kohlenstoff-Atoms an ein Monomer, bei diesem immer eine Spaltung der Doppelbindung und Umlagerung der einzelnen Elektronen statt. Diese Reaktion kann theoretisch immer so weiter ablaufen, bis schließlich das Monomer aufgebraucht ist.
Bei der radikalischen Polymerisation sind zwei einfache Reaktionen denkbar, bei denen zu einem Abbruch der Kettenreaktion ohne weiteres Zutun kommt. In beiden Fällen "verschwindet" das Radikal und somit kann die Wachstumsreaktion nicht mehr weiter ablaufen.
1. Möglichkeit: Beim das Zusammentreffen zweier Radikale bilden beide einzelnen Atome zusammen eine Elektronenpaarbindung.
2. Möglichkeit: Innerhalb eines der Radikale findet die Bildung einer Doppelbindung statt und das dabei freiwerdende Wasserstoff-Radikal bindet sich an ein anderes Radikal. Hier ist zu beachten, dass der eine Pfeil nicht nur einen Elektronenumlagerung sondern auch die Umlagerung des Wasserstoffs bewirkt, zu dem das Elektron gehört.
Wie lang die Ketten werden, hängt im wesentlichen nicht davon ab, wieviel des Monomers man zur Verfügung stellt. Man kann die Kettenlänge aber steuern und das sollte leicht erklärbar sein.
Die Kettenlänge der Makromoleküle ist niemals bei allen Molekülen identisch. Allerdings kann man die durchschnittliche Länge der Ketten steuern, indem man die Menge an Radikal-Starter variiert. Daher die Frage:
- Wie wirkt sich die Zugabe einer größeren Menge an Radikalstarter auf die durchschittliche Kettenlänge der Makromoleküle aus? Werden sie länger oder kürzer?
Es gibt auch sogenannte Kettenüberträger, die gezielt zu bestimmten Zeitpunkten der Polymerisation zugegeben werden, um das aktive Zentrum einer wachsenden Polymerkette auf ein anderes Molekül zu übertragen.
- P• + XR → PX + R•
- P = Polymerkette, XR = Kettenüberträger
Übungsaufgaben zu Monomeren und Polymeren
Zunächst einmal ist die Art der Polymerisation für uns nicht von großer Bedeutung, denn welche Art der Polymerisation genutzt wird, ist eher ein praktisches Problem, das wir nicht nachvollziehen können und müssen. Es spielt für die Industrie natürlich schon ein Rolle.
Wir konzentrieren uns erst einmal auf mögliche Edukte und Produkte einer Polymerisation. Bei den folgenden Aufgaben geht es darum zu einem Monomer das passende Polymer zu suchen und umgekehrt, außerdem wird die Repetiereinheit betrachtet. Hier werden anhand des Polypropylens noch einmal die wichtigen Begriffe und ihr Zusammenhang gezeigt, damit klar ist, was ihr bei den folgenden Aufgaben bestimmen sollt:
a.) PVC (= Polyvinychlorid) ist das drittwichtigste Polymer und ist besonders beständig gegen Sonnenlicht und andere Witterungseinflüsse. Es wird aus dem Monomer CH2=CHCl gebildet.
- Zeichne eine Polymerkette, die 4 Repetiereinheiten enthält und schreibe das Polymer kurz mit Hilfe der Repetiereinheit.
- Gib den Namen des Monomers an.
- TIPP: Schreibe das Monomer erst einmal in die Lewisschreibweise um, statt in der gegebenen Halbstrukturschreibweise.
b.) Das Monomer Acrylamid (siehe rechts) bildet wasserlösliche Polymerketten. Es wird auch für die Herstellung von Superabsorbern in Windeln genutzt.
- Zeichne zunächst das Monomer in Lewisschreibweise so, dass die Doppelbindung waagerecht "liegt" und die andere Atome entsprechend daran hängen.
- Zeichne eine Polymerkette, die 4 Repetiereinheiten enthält und schreibe das Polymer kurz mit Hilfe der Repetiereinheit.
- Wie ist der Name des Polymers?
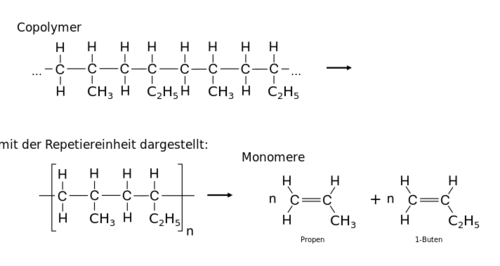
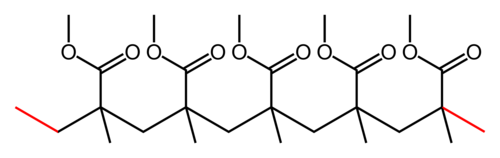
Schreibe die angegebenen Poylmerketten mit Hilfe einer Repetiereinheit auf und bestimme das Monomer dazu.
- Schreibe zuerst die angegebene Skelettschreibweise um, in die Lewisschreibweise (zumindest alle C-Atome aufschreiben) und zeichne die Hauptkette gerade/waagrecht ein.
- Markiere dann die Repetiereinheit!

Zu den zwei gegebenen Monomere soll die Polymerkette eines alternierenden Co-Polymers gezeichnet werden.
Einsatz von Katalysatoren
Von der Definition her, sind Katalysatoren sicherlich bekannt unter der folgenden Definition:
Bei der Herstellung von Kunststoffen haben Katalysatoren üblicherweise zwei mögliche Einsatzgebiete:
- Durch die Senkung der Aktivierungsenergie kann die Polymerisation schon bei Normal-Temperatur stattfinden. Das führte zum Beispiel beim Polyethylen dazu, das man statt dem bisher bei hohen Temperatur erzeugten Polyethylen mit vielen größeren Seitenketten, mit Hilfe des Ziegler-Natta-Katalysators bei Raumtemperaturen ein nahezu ganz lineares Molekül erzeugen konnte.
- Der Katalysator hält das "Ende" der Polymerkette und ebenso ein Monomer "fest", aktiviert sie bringt sie so in Kontakt und erleichtert so die Reaktion.

- Ist das Monomer unsymmetrisch können die Seitenketten der einzelnen Monomere räumlich unterschiedlich an der langen Kette hängen. Diese als Taktizität bezeichnete Eigenschaft des Molekül-Aufbaus hat eine durchaus große Auswirkung auf die Eigenschaften des Polymers. Das folgende Bild zeigt drei Varianten der Taktizität.

- Der Katalysator sorgt nicht nur für eine vereinfachte Reaktion, sondern bewirkt auch eine regelmäßige Anordnung der Seitenketten, da die Monomere immer von der gleichen Seite an die Kette angefügt werden.
Versuch: Herstellung von Plexiglas
Polymethylmethacrylat oder kurz PMMA ist auch unter dem Namen Acrylglas bekannt. Vom Chemiker Otto Röhm aus Darmstadt (heute die Firma Evonik/Röhm) wurde es 1933 unter dem Namen Plexiglas als Patent angemeldet. In der DDR verwendete man die Bezeichnung O-Glas (für „organisches Glas“).
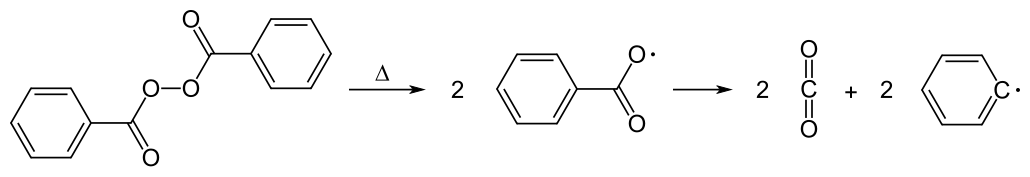
Üblicherweise wird Acrylglas auch industriell über eine radikalische Polymerisation mit Hilfe des Initiators Dibenzoylperoxid hergestellt. Die dadurch entstehende Makromoleküle sind völlig amorph und ataktisch.
Dibenzolyperoxid ist ein organisches Peroxid, das schon bei geringster Wärmezufuhr in zwei gleiche Radikale zerfällt, die dann Kohlendioxid abspalten.
- Reagenzglas
- Becherglas mit Wasser auf Heizplatte
- Uhrglas, dass mit Alufolie ausgekleidet ist
- 5 ml Methacrylsäuremethylester
- 2 Spatelspiten Dibenzoylperoxid
Durchführung:
- In das Reagenzglas werden etwa 5 ml Methacrylsäuremethylester und 2 Spatelspitzen Dibenzoylperoxid gegeben.
- Die Lösung wird im Wasserbad erwärmt. Sobald man eine Reaktion zu beobachten kann, wird das Reagenzglas aus dem Wasserbad herausgenommen und die Masse auf die Alufolie ausgegossen und man wartet, bis sich das Material verfestigt hat.
Entsorgung:
- Das Reagenzglas kann nach dem Abkühlen in den Restmüll entsorgt werden.
Die Struktur der Polymere
Ein sehr großen Einfluss auf die Eigenschaften des Polymers hat die Grundstruktur des Makromoleküls. Auch bei gleichem Monomer gibt es dabei verschiedene Varianten-
- Es können sich lineare Makromoleküle bilden, die nur aus einer Polymerkette bestehen. Im Fall von Polyethylen z.B. ist die Hauptkette ein langkettiges, unverzweigtes Alkan.
- Bei entsprechenden Reaktionsbedingungen bilden sich auch verzweigte Makromoleküle mit einer Hauptkette und Seitenketten, bei verzweigtem Polyethylen wären es dann Alkylreste.
Neben der Kettenlänge bestimmt auch der Verzweigungsgrad Dichte, Festigkeit und Schmelzpunkt des Polymers. Je nach Anordnung der verschiedenen Molekülketten im Material kann es zu unterschiedlich starken Wechselwirkungen dazwischen kommen. Wenn nicht polare Gruppierungen enthalten sind, spielen nur die Van-der-Waals-Kräfte dabei eine Rolle.
Ungeordnete und stark verzweigte Polymere sind amorph, die Moleküle im Feststoff können nur ungeordnet miteinander wechselwirken. Unverzweigte Makromoleküle können als Feststoff eine teilkristalline Struktur ausbilden, bei der aufgrund einer parallelen Anordnung der Molekülketten relativ starke Van-der-Waals-Kräfte wirken können.
Während verzweigte und unverzweigte Polymere in der Regel sogenannte Thermoplaste sind, liegen bei den Elastomeren eine weitmaschige Vernetzung zwischen den „Hauptketten“ vor. Eine engmaschige Vernetzung führt hingegen zu Duroplasten.
Vernetzungen und Verzweigungen sind in den Abbildungen als rote Punkte dargestellt. Die roten, parallel liegenden Streifen sind die kristallinen Bereiche.
Einteilung in Thermoplasten, Elastomere und Duroplasten
Grob werden alle Polymere in drei Gruppen eingeteilt, mit denen ihre grundlegenden Eigenschaften beschrieben werden.
Die Thermoplasten haben ihre Namen davon, dass sie bei Erwärmung plastisch werden, also verformt werden können.
Damit dies möglich ist, darf es zwischen den einzelnen Kettenmolekülen keine stabilen Verbindungen in Form von Atombindungen geben. Besteht zwischen den einzelnen Kettenmolekülen nur eine Anziehung über Van-der-Waals-Kräfte oder Dipol-Dipol-Wechselwirkungen, so lösen sich diese beim Erwärmen, wenn die Ketten aus durch die Erwärmung in Schwingung geraten. Eine Atombindung kann dagegen bei "normalen" Temperaturen nicht gelöst werden.
Zu den Thermoplasten gehören solche Kunststoffe wie das Polyethylen und das Polypropylen.
Ursache der Elastizität ist die typische Struktur von Elastomeren, bei denen es zwischen den einzelnen Kohlentoffketten in größeren Abständen Atombindungen gibt. Bei Krafteinwirkung kann der geknäulte, nicht verknüpfte Anteil der Polymerketten entflechtet und somit langgezogen werden. Nach Wegfall der Zugbelastung entspannen die Ketten und kehren in ihren bevorzugten, knäuelartigen, Zustand zurück. Man beachte, dass das nur geht, weil die Schmelztemperaturen der Elastomere niedriger sind als bei den Thermoplasten.
Duroplaste sind Kunststoffe, die nach ihrer Aushärtung nicht mehr verformt werden können. Sie haben also eine dauerhafte Struktur und sind nicht wie die Thermoplaste durch Erwärmen verformbar. Außerdem sind sie meist hart und unlöslich in alle möglichen Lösungsmittel.
Der Grund dafür ist, dass die Polymer-Ketten über viele Atombindungen miteinander verknüpft sind. Damit man Werkstücke in einer ebstimmten Form bekommt, werden meist Vorprodukte verwendete, die noch schmelzbar oder löslich sind (meist sind es Kunstharze) weil sie noch nicht engmasching vernetzt sind, aber Vernetzungsmöglichkeiten haben. Mit Hilfe von Härtern und evtl. Katalysatoren oder auch hohe Temperaturen polymerisieren sie dann in ihrer Form.
Da die Atombindungen stabil sind, können Sie nicht durch einfaches Erwärmen geschmolzen werden. Erst sehr hohe Temperaturen können die Atombindungen zerstören, wodurch aber die innere Struktur des Material unwiderbringbar zerstört wird und somit keine Umformung, wie bei den Thermoplasten möglich ist.
Teilkristalline Polymere
Bei thermoplastischen Polymeren gibt es noch zwei Untervarianten. Denn auch wenn es keine Atombindungen zwischen den Makromolekülen gibt, so können sie sich doch stark anziehen, dass sich strukturierte Bereiche, mit parallel liegenden Ketten, bilden. Ist das der Fall, so hat man ein teilkristallines Polymer. Dem gegenüber stehen die amorphen Polymere, also solche, bei denen die Makromoleküle einfach ungeordnet durcheinander liegen. Das entspricht einem normalen Thermoplast.
Ob ein Polymer teilkristallin ist oder amorph hat auf einige Eigenschaften eine wesentliche Auswirkung. Das werden wir an konkreten Beispielen dann genauer besprechen.
Die Entstehung von teilkristalline Bereichen hängt entweder von der Verarbeitung ab oder vom Molekülbau. Bei der Verarbeitung werden zum Beispiel für Fasern durch Verstreckung (also langziehen) die Molekülketten zum Teil parallel angeordnet. Beim Molekülbau können stark polare Seitenketten eine starke Anziehung bewirken, die dann zu einer parallelen Anordnung der Ketten führt.
Transparenz von Kunststoffen
Zu Beginn klären wir kurz zwei wichtige Begriffe:
Ein Stoff ist transparent, wenn er durchscheinend ist.
Ein Stoff ist ist opak, wenn er nicht durchscheinend ist.
Ein bekannter transparenter Stoff ist Glas. Gewöhnlich wird Glas durch Schmelzen erzeugt. Physikalisch wird Glas als gefrorene, unterkühlte Flüssigkeit bezeichnet, die sehr schnell abgekühlt wurde. Das bedeutet, dass sich bei der Erstarrung der Schmelze zum Glas zwar Kristallkeime bilden, für eine vollständige Kristallisation jedoch nicht genügend Zeit bleibt.
Das erstarrende Glas ist zu schnell fest, um noch eine Umordnung der Bausteine zu einem regelmäßig angeordneten Kristall zu erlauben. Vereinfachend entspricht somit der atomare Aufbau eines Glases in etwa dem einer Flüssigkeit. Glas ist daher eine amorphe Substanz, d.h. man hat keine geordnete Struktur.
Damit ein Polymer transparent ist, müssen wir also ähnliche Bedingungen wie im Glas haben, nämlich dass wir eine möglichst ungeordnete Struktur haben. Daher können nur amorphe Polymere transparent sein. Umgekehrt führen teilkristalline Bereiche dazu, dass ein Polymer nicht transparent ist. Als Begründung sollen die zwei folgenden Bilder dienen:
Im Bild sieht man eine Probe von PET (Polyethylenterephthalat), dass man vor allem von Kunststoffflaschen kennt. Normalerweise transparent (also amorph) kann kruzfristiges Erhitzen an einer Stelle dazu führen dass dort ein Kristiallisationsprozess einsetzt, der bewirkt, dass PET nicht mehr transparent ist.
Ein weiterer Grund dafür, dass teilkristalline Polymere nicht transparent sind ist, dass die zwischen den kristallinen Bereichen liegenden amorphen Gebieten eine andere optische Dichte haben als, die ebenfalls zu einer Brechnung des Lichtstrahl führt.
Typisch an transparenten Kunststoffen ist, dass ist meist Monomere mit sehr große und starre Seitenketten haben oder selber sehr groß sind. Dies kann dazu beitragen, dass die Anordnung der Ketten eher Dazu als Beispiel zwei Kunststoffe, die meist aufgrund ihrer Transparenz genutzt werden.