Elementarteilchen und Radioaktiver Zerfall/Der Aufbau eines Atoms: Unterschied zwischen den Versionen
Mono13 (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
K (FrauSchütze verschob die Seite Der Aufbau eines Atoms nach Elementarteilchen und Radioaktiver Zerfall/Der Aufbau eines Atoms) |
||
| (32 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{{2Spalten| | |||
Schon im antiken Griechenland haben sich Philosophen Gedanken zum Aufbau der Materie gemacht. Aus dieser Zeit stammt der Begriff des Atoms. Er leitet sich vom griechischen "atomos" ab, was übersetzt etwa so viel wie "nicht spaltbar" bedeutet. Die alten Griechen sind früher also davon ausgegangen, dass Materie aus kleinsten Teilchen mit dem Namen Atom bestehen und dass diese Atome der Materie ihre Eigenschaften geben. | Schon im antiken Griechenland haben sich Philosophen Gedanken zum Aufbau der Materie gemacht. Aus dieser Zeit stammt der Begriff des Atoms. Er leitet sich vom griechischen "atomos" ab, was übersetzt etwa so viel wie "nicht spaltbar" bedeutet. Die alten Griechen sind früher also davon ausgegangen, dass Materie aus kleinsten Teilchen mit dem Namen Atom bestehen und dass diese Atome der Materie ihre Eigenschaften geben. | ||
Den Gedanken der "Nichtspaltbarkeit" kann man verstehen, wenn man sich z.B. einen Eisenwürfel vorstellt, den man halbiert. Dann stellt man sich vor, wie man die Hälfte des Eisenwürfels erneut halbiert. So macht man immer wieder weiter. Nach den Gedanken der alten Griechen ist dieses Verfahren nicht unendlich lang weiterführbar, weil man irgendwann nur noch das | Den Gedanken der "Nichtspaltbarkeit" kann man verstehen, wenn man sich z.B. einen Eisenwürfel vorstellt, den man halbiert. Dann stellt man sich vor, wie man die Hälfte des Eisenwürfels erneut halbiert. So macht man immer wieder weiter. Nach den Gedanken der alten Griechen ist dieses Verfahren nicht unendlich lang weiterführbar, weil man irgendwann nur noch das '''nicht spaltbare''' kleinste Eisenteil, '''das Eisenatom''', übrig hat. | ||
Etwa | Etwa zwei Jahrtausende später entdeckt der Physiker '''J. J. Thomson''' die negativ geladenen Elektronen, die um ein Vielfaches kleiner sind als das Atom selbst. Außerdem gibt es Gründe zur Annahme, dass Elektronen Teil jedes Atoms sind. Das Bild der unteilbaren Atome ist erschüttert. | ||
Es stellt sich eine Frage: | Es stellt sich eine Frage: ''Wenn Atome insgesamt elektrisch neutral geladen sind, aber elektrisch negativ geladene Elektronen beinhalten, was für Teilchen existieren dann noch im Atom, um die negative Ladung auszugleichen?'' | ||
Das motivierte viele Physiker und ein neues Forschungsgebiet entstand. Sie versuchten, ein Modell für den Aufbau der Atome zu erstellen. | Das motivierte viele Physiker und ein neues Forschungsgebiet entstand. Sie versuchten, ein Modell für den Aufbau der Atome zu erstellen. | ||
Ein erstes Modell kam von J. J. Thomson selbst. Er modellierte das Atom wie den Teig von Rosinenkuchen: ''Ein Atom sei laut Thomson ein Kügelchen gewesen, in dem Masse und positive Ladung gleichmäßig verteilt sind. In diesem Kügelchen eingebettet sind wie Rosinen im Kuchenteig die punktförmigen, negativ geladenen Elektronen''. | Ein erstes Modell kam von J. J. Thomson selbst. Er modellierte das Atom wie den Teig von Rosinenkuchen: ''Ein Atom sei laut Thomson ein Kügelchen gewesen, in dem Masse und positive Ladung gleichmäßig verteilt sind. In diesem Kügelchen eingebettet sind wie Rosinen im Kuchenteig die punktförmigen, negativ geladenen Elektronen''. | ||
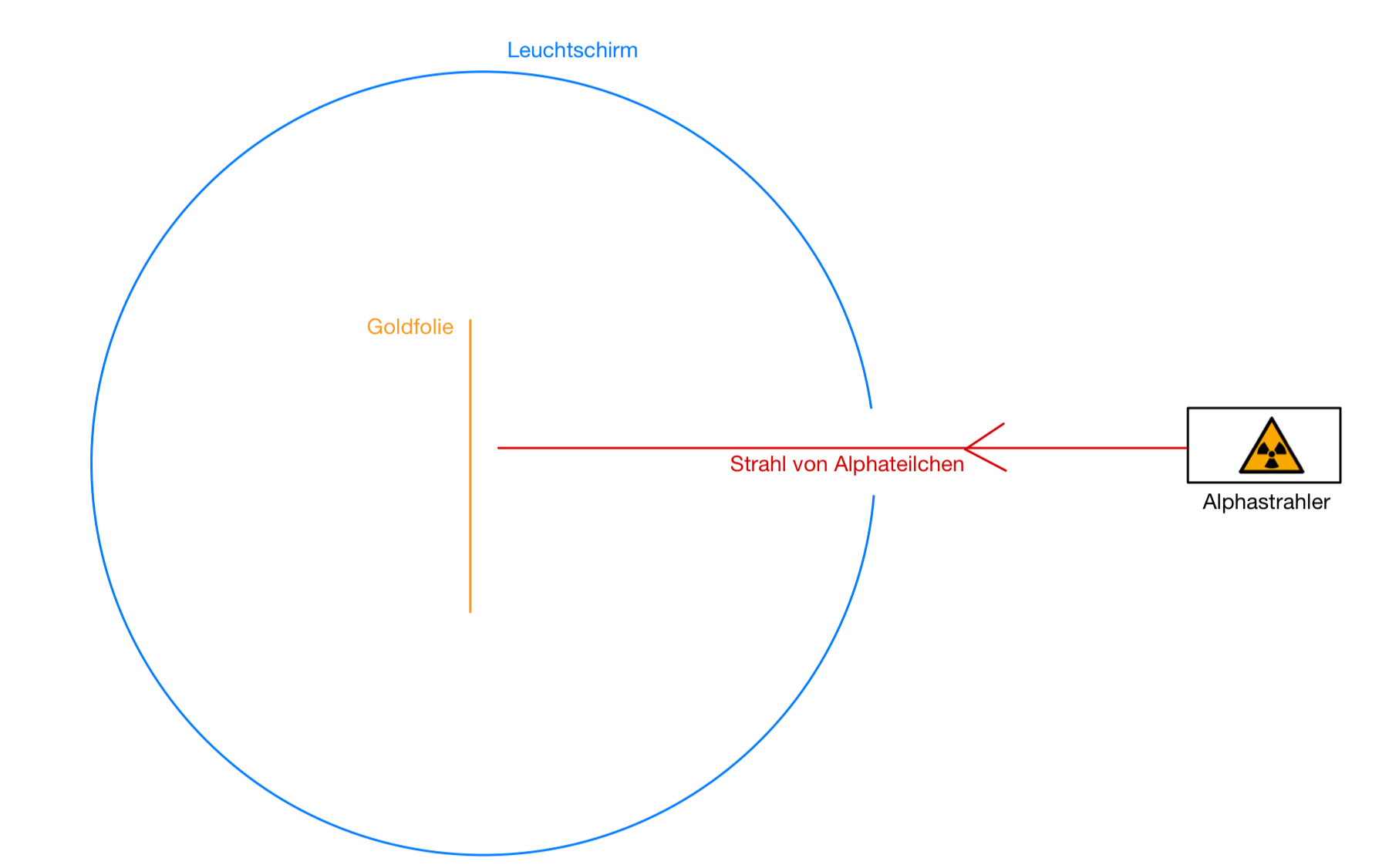
Der Physiker Ernest Rutherford wollte 1911 das Modell Thomsons überprüfen. Dazu führte er seinen | Der Physiker Ernest Rutherford wollte 1911 das Modell Thomsons überprüfen. Dazu führte er seinen Streuversuch durch. Er wird auf der Skizze dargestellt. | ||
In dem Versuch schoss er positiv geladene Alpha-Teilchen auf eine dünne Goldfolie. Um die Goldfolie herum war ein | In dem Versuch schoss er positiv geladene Alpha-Teilchen auf eine dünne Goldfolie. | ||
Um die Goldfolie herum war ein Leuchtschirm. Er begann an den Stellen zu leuchten, wo er von Alpha-Teilchen getroffen wurde. So ließen sich Aussagen über die Bewegungsbahn der einzelnen Alpha-Teilchen treffen. | |||
| | |||
[[Datei:Rutherford-Streuversuch.jpg|Rutherford-Streuversuch.jpg]] | |||
}} | |||
==Simulation des Versuchs von Rutherford== | |||
Der Versuchsaufbau Rutherfords wird in der obigen Abbildung dargestellt. In der Simulation wird dargestellt, was bei dem Versuch auf atomarer Ebene passiert. Dabei wird im Rosinenkuchenatom gezeigt, wie der Versuch laufen würde, wenn Thomsons Modell stimmt und im Rutherfordatom, was tatsächlich beobachtet wurde. '''Führe den Versuch Rutherfords in der Simulation unter dem folgenden Link mit dem Rutherford-Atom durch.''' | |||
https://phet.colorado.edu/sims/html/rutherford-scattering/latest/rutherford-scattering_all.html?locale=de | https://phet.colorado.edu/sims/html/rutherford-scattering/latest/rutherford-scattering_all.html?locale=de | ||
{{Box | {{Box | ||
|Aufgaben 1.1: Auswertung des Versuchs | |Aufgaben 1.1: Auswertung des Versuchs | ||
|Beschreibe deine Beobachtung beim Rutherford-Atom, indem du den Satzanfängen das passende Ende zuordnest | |'''Beschreibe deine Beobachtung beim Rutherford-Atom''', indem du den Satzanfängen das passende Ende zuordnest | ||
|Arbeitsmethode | |Arbeitsmethode | ||
}} | }} | ||
<div class="lueckentext-quiz"> | <div class="lueckentext-quiz"> | ||
Die meisten Alpha-Teilchen ''' | Die meisten Alpha-Teilchen '''bewegen sich unverändert weiter.''' | ||
Ein paar Alpha-Teilchen ''' | Ein paar Alpha-Teilchen '''werden leicht abgelenkt.''' | ||
Wenige Alpha-Teilchen '''werden in ihre Herkunftsrichtung zurückgeworfen.''' | Wenige Alpha-Teilchen '''werden in ihre Herkunftsrichtung zurückgeworfen.''' | ||
| Zeile 38: | Zeile 67: | ||
{{Box | {{Box | ||
|Aufgaben 1.2: Auswertung des Versuchs | |Aufgaben 1.2: Auswertung des Versuchs | ||
|Erkläre, warum einige Alpha-Teilchen abgelenkt werden und andere nicht. | |'''Erkläre,''' warum einige Alpha-Teilchen abgelenkt werden und andere nicht. | ||
|Arbeitsmethode | |Arbeitsmethode | ||
}} | }} | ||
{{Lösung versteckt|1=Du weißt doch schon, dass gleiche Ladungen einander abstoßen und ungleiche sich anziehen. Was hat das mit diesem Versuch zu tun?|2=Hilfe|3=Schließen}} | |||
{{Box | {{Box | ||
|Aufgaben 1.3: Auswertung des Versuchs | |Aufgaben 1.3: Auswertung des Versuchs | ||
|Deute, was das Verhalten der Alpha-Teilchen für den Aufbau des Atoms bedeutet. | |'''Deute,''' was das Verhalten der Alpha-Teilchen für den Aufbau des Atoms bedeutet. | ||
|Arbeitsmethode | |Arbeitsmethode | ||
}} | }} | ||
== | {{Lösung versteckt|1=Wieso werden die meisten Alpha-Teilchen nicht abgelenkt?|2=Hilfe|3=Schließen}} | ||
[[Der Aufbau eines Atoms]] | == Lerneinheiten == | ||
1. [[Der Aufbau eines Atoms]] | |||
[[Kennzahlen von Atomkernen]] | 2. [[Kennzahlen von Atomkernen]] | ||
[[Radioaktivität]] | 3. [[Radioaktivität]] | ||
[[Nachweis von Radioaktivität]] | 4. [[Nachweis von Radioaktivität]] | ||
[[Verschiedene Arten von Strahlung]] | 5. [[Verschiedene Arten von Strahlung]] | ||
[[Aktivität]] | 6. [[Aktivität]] | ||
[[Halbwertszeit]] | 7. [[Halbwertszeit]] | ||
[[Zerfallsgesetz]] | 8. [[Zerfallsgesetz]] | ||
Aktuelle Version vom 24. November 2023, 21:37 Uhr
Schon im antiken Griechenland haben sich Philosophen Gedanken zum Aufbau der Materie gemacht. Aus dieser Zeit stammt der Begriff des Atoms. Er leitet sich vom griechischen "atomos" ab, was übersetzt etwa so viel wie "nicht spaltbar" bedeutet. Die alten Griechen sind früher also davon ausgegangen, dass Materie aus kleinsten Teilchen mit dem Namen Atom bestehen und dass diese Atome der Materie ihre Eigenschaften geben.
Den Gedanken der "Nichtspaltbarkeit" kann man verstehen, wenn man sich z.B. einen Eisenwürfel vorstellt, den man halbiert. Dann stellt man sich vor, wie man die Hälfte des Eisenwürfels erneut halbiert. So macht man immer wieder weiter. Nach den Gedanken der alten Griechen ist dieses Verfahren nicht unendlich lang weiterführbar, weil man irgendwann nur noch das nicht spaltbare kleinste Eisenteil, das Eisenatom, übrig hat.
Etwa zwei Jahrtausende später entdeckt der Physiker J. J. Thomson die negativ geladenen Elektronen, die um ein Vielfaches kleiner sind als das Atom selbst. Außerdem gibt es Gründe zur Annahme, dass Elektronen Teil jedes Atoms sind. Das Bild der unteilbaren Atome ist erschüttert. Es stellt sich eine Frage: Wenn Atome insgesamt elektrisch neutral geladen sind, aber elektrisch negativ geladene Elektronen beinhalten, was für Teilchen existieren dann noch im Atom, um die negative Ladung auszugleichen?
Das motivierte viele Physiker und ein neues Forschungsgebiet entstand. Sie versuchten, ein Modell für den Aufbau der Atome zu erstellen. Ein erstes Modell kam von J. J. Thomson selbst. Er modellierte das Atom wie den Teig von Rosinenkuchen: Ein Atom sei laut Thomson ein Kügelchen gewesen, in dem Masse und positive Ladung gleichmäßig verteilt sind. In diesem Kügelchen eingebettet sind wie Rosinen im Kuchenteig die punktförmigen, negativ geladenen Elektronen.
Der Physiker Ernest Rutherford wollte 1911 das Modell Thomsons überprüfen. Dazu führte er seinen Streuversuch durch. Er wird auf der Skizze dargestellt. In dem Versuch schoss er positiv geladene Alpha-Teilchen auf eine dünne Goldfolie.
Um die Goldfolie herum war ein Leuchtschirm. Er begann an den Stellen zu leuchten, wo er von Alpha-Teilchen getroffen wurde. So ließen sich Aussagen über die Bewegungsbahn der einzelnen Alpha-Teilchen treffen.
Simulation des Versuchs von Rutherford
Der Versuchsaufbau Rutherfords wird in der obigen Abbildung dargestellt. In der Simulation wird dargestellt, was bei dem Versuch auf atomarer Ebene passiert. Dabei wird im Rosinenkuchenatom gezeigt, wie der Versuch laufen würde, wenn Thomsons Modell stimmt und im Rutherfordatom, was tatsächlich beobachtet wurde. Führe den Versuch Rutherfords in der Simulation unter dem folgenden Link mit dem Rutherford-Atom durch.
Beschreibe deine Beobachtung beim Rutherford-Atom, indem du den Satzanfängen das passende Ende zuordnest
Die meisten Alpha-Teilchen bewegen sich unverändert weiter.
Ein paar Alpha-Teilchen werden leicht abgelenkt.
Wenige Alpha-Teilchen werden in ihre Herkunftsrichtung zurückgeworfen.
Erkläre, warum einige Alpha-Teilchen abgelenkt werden und andere nicht.
Deute, was das Verhalten der Alpha-Teilchen für den Aufbau des Atoms bedeutet.
Lerneinheiten
4. Nachweis von Radioaktivität
5. Verschiedene Arten von Strahlung
6. Aktivität