Chemie-Lexikon/Stöchiometrie - Satz von Avogadro: Unterschied zwischen den Versionen
K ({{SORTIERUNG:{{SUBPAGENAME}}}}) Markierung: Quelltext-Bearbeitung 2017 |
K (Bot: Ergänze Kategorie Chemie) |
||
| (37 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{{SORTIERUNG:{{SUBPAGENAME}}}}<div class="grid"> | {{SORTIERUNG:{{SUBPAGENAME}}}}<div class="grid"> | ||
<div class="width-3-4">Der | <div class="width-3-4">Der Italiener '''Amadeo Avogadro''' war Professor für mathematische Physik und untersuchte im 19. Jahrhundert Gase. Dabei stieß er auf eine Besonderheit bei der Anzahl der Gasteilchen pro Volumeneinheit. | ||
</div> | </div> | ||
<div class="width-1-4">[[File:Avogadro Amedeo.jpg]]</div> | <div class="width-1-4">[[File:Avogadro Amedeo.jpg]]</div> | ||
| Zeile 6: | Zeile 6: | ||
{{Box|AKTIVITÄT (Freiwillig) - Entdecke den Satz von Avogadro über die Dichte| | {{Box|AKTIVITÄT (Freiwillig) - Entdecke den Satz von Avogadro über die Dichte| | ||
Auf '''→ [[/Den Satz von | Auf '''→ [[/Den Satz von Avogadro theoretisch entdecken/|dieser Unterseite]]''' kannst du mit Hilfe von recht einfachen Berechnungen die Entdeckung des Satzes von Avogadro nachvollziehen. | ||
|3=Lernpfad}} | |3=Lernpfad}} | ||
==Avogadros Überlegungen== | |||
Ende des 18. Jahrhunderts hatte man endlich ausreichend gute Waagen, um die Dichte von Gasen zu bestimmen. Dazu gehört auch die zwei Gasarten, die bei der Elektrolyse von Wasser gewonnenen werden, also Sauerstoff und Wasserstoff. | |||
[[File:Antoine lavoisier.jpg|right|200px]]Ein wichtiger Chemiker zur Zeit Avogadros war der Franzose {{wpde|Antoine_Laurent_de_Lavoisier|Antoine de Lavoisier}}. Er stellte fest, dass alle chemischen Stoffe aus den Elementarstoffen, '''den Elementen''', aufgebaut sind. Die damals bekannten Metalle wie Silber, Kupfer, Blei, Zinn wurden von Lavoisier als Elemente eingeordnet. Und diese Elemente konnten mit dem Gas der Luft – ''Oxygène'', also Sauerstoff – Verbindungen eingehen, wodurch zusammengesetzte Stoffe wie Bleioxid, Zinnoxid oder Kupferoxid entstanden. Lavoisier nannte die Stoffe, die wir heute als Elemente bezeichnen würden, als ''Substances simples'' ''(einfache Substanzen)'', weil sie sich nach Lavoisier nicht weiter mit chemischen Mitteln zerlegbar ließen. | |||
Bei einigen Stoffen war also klar, ob sie Elemente und Verbindungen waren. Aber nicht bei allen! So fragten sich die Chemiker damals, woran man erkennen kann, ob ein Stoff jetzt eine Element oder eine Verbindung ist? Die Gase waren dabei der Schlüssel zur Bestimmung der Elemente. | |||
Da sich Sauerstoff und Wasserstoff von Wasserdampf unterschieden, musste das Wasser, das ja bei einer Knallgasexplosion aus Sauerstoff und Wasserstoff entstand, ein zusammengesetzter Stoff sein. | |||
Avogadro leitete sein Gesetz aus den von Gay-Lussac gefundenen gesetzmäßigen Beziehungen bei gasförmigen Stoffen ab. | |||
{{Box|Gesetze von Gay-Lussac |2= | |||
'''1. Gesetz:''' Der Quotient aus '''Volumen''' und '''Temperatur''' bei einem Gas ist bei gleichbleibender Menge und Druck gleich: | |||
:<math>\frac{V}{T} = \text{konst} \qquad \qquad \frac{V_1}{V_2} = \frac{T_1}{T_2}</math> | |||
'''2. Gesetz:''' Der '''Druck''' von Gasen ist bei gleichbleibendem Volumen und gleichbleibender Teilchenanzahl direkt proportional zur '''Temperatur''', weswegen der Quotient gleich bleibt. | |||
:<math>\frac{p}{T} = \text{konst} \qquad \qquad \frac{p_1}{p_2} = \frac{T_1}{T_2}</math> | |||
|3=Merksatz}} | |||
Daraus folgerte Avogadro seinen Satz, wobei er auch Begriffe wie ''molécules élémentaires'' (Atome) und ''molécules intégrantes'' (Moleküle) verwendete, sein Gesetz galt aber auch Gasgemische. Bei seinen Überlegungen nahm Avogadro an, dass auch die Elemente zusammengesetzt sein können. Denn jedes Molekül eines Elementes in der Gasphase sollte aus zwei Atomen des Elementes bestehen, was wir ja von Sauerstoff O<sub>2</sub>, Stickstoff N<sub>2</sub>, Wasserstoff H<sub>2</sub> usw. kennen. Die einatomigen Edelgase waren damals noch nicht bekannt. | |||
Die Idee Avogadros war nicht unumstritten, denn einige Chemiker waren der Meinung, dass die von ihm quasi eingeführten "Moleküle" aus mindestens 8 Atomen bestehen müssten. Dies konnte aber widerlegt werden. Stattdessen wurde mit Hilfe der Dichte von Gasen und dem "Satz von Avogadro" durch '''Jean Baptiste Dumas''' die Molekülmassen einer Vielzahl von gasförmigen Stoffen bestimmt und '''Charles Frédéric Gerhardt''' formulierte mit Hilfe der Dichte und den Molekülmassen die Formeln für Chlorwasserstoff, Wasser, Ammoniak, Kohlenstoffdioxid. Dabei ergaben sich allerdings Widersprüche zu den Atommassen, die von Berzelius in einer erste Liste mit Elementen und den von ihm erfundenen Symbolen, aufgestellt worden sind. | |||
Es folgten viele weitere Experimente und Untersuchungen an Gasen und erst ein halbes Jahrhundert später nach ihrer ersten Formulierung gelangten Avogadros Ansichten wirklich zur Geltung. Avogadros Gesetz war damit von großer Bedeutung, insbesondere für die Chemie. Es ist aber auch für die Physik bedeutend, vor allem für die kinetische Gastheorie, die von James Clerk Maxwell weiterentwickelt wurde. Der Satz von Avogadro ist auch – wenn auch versteckt – in der allgemeinen Gasgleichung enthalten. | |||
:<math>p \cdot V = n \cdot R_m \cdot T</math> | |||
==Der Satz von Avogadro== | |||
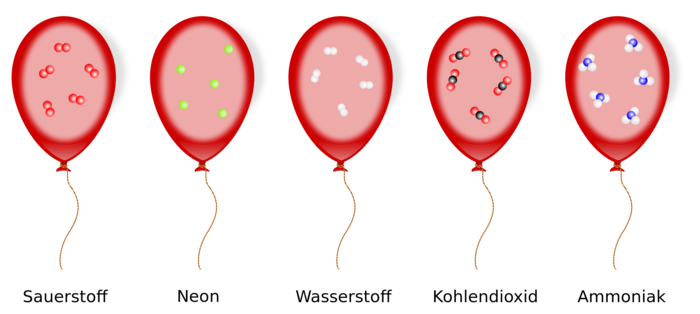
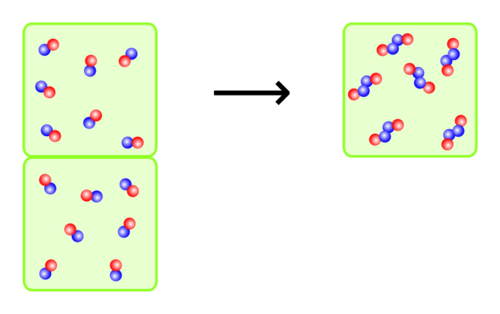
Das Gesetz von Avogadro sagt aus, dass zwei gleich große Gasvolumina, die unter demselben Druck stehen und die dieselbe Temperatur haben, auch dieselbe Teilchenanzahl einschließen. Dies gilt sogar dann, wenn die Volumina verschiedene Gasarten gemischt enthalten. Umgekehrt kann man daraus schließen, dass ein Gaspaket in einem bestimmten Volumen auch eine bestimmte Anzahl von Teilchen hat, die unabhängig von der Stoffart ist. | |||
{{Box|Satz von Avogadro|2= | |||
Alle Gase enthalten bei gleicher Temperatur und gleichem Druck in gleichen Volumina die gleiche Teilchenzahl. | |||
[[Datei:Satz von Avogadro.svg|700px|center]]|3=Merksatz}} | |||
==Für was ist der Satz von Avogadro wichtig?== | |||
Die Chemiker im 19. Jahrhundert haben den Satz von Avogadro mit Hilfe von einigen Beobachtungen "gefunden". Umgekehrt können wir diesem Satz nun auch nutzen und einige Phänomene und Beobachtungen erklären. Also von Volumina auf die Anzahl der Teilchen und damit auf mögliche Formeln von Verbindungen schließen. | |||
<div class="grid"> | |||
<div class="width-2-3"> | |||
:Bei der '''Elektrolye von Wasser''' entstehen Wasserstoff und Sauerstoff immer im Volumen-Verhältnis 2 zu 1. Daraus kann man die Formel von Wasser herleiten, wenn man den Satz von Avogadro kennt. | |||
::<math>2 H_2O \; \longrightarrow \; 2 H_2 \;+\; O_2</math> | |||
:[[Datei:Satz von Avogadro bei Wasser-Elektrolyse.svg]] | |||
</div> | |||
<div class="width-1-3"><center>[[File:Hofmann voltameter.svg|200px]]</center></div> | |||
</div> | |||
Wir wissen auch, in welchen Volumina gasförmige Verbindungen miteinander reagieren. | |||
<div class="grid"> | |||
<div class="width-2-3"> | |||
:Zur '''Herstellung von Ammoniak''' braucht man Wasserstoff und Stickstoff. Denn die Formel von Ammoniak ist NH<sub>3</sub> und somit braucht man ein dreimal so großes Volumen an Wasserstoff wie an Stickstoff. | |||
::<math>N_2 \; + \; 3 H_2 \; \longrightarrow \; 2 NH_3</math> | |||
:[[Datei:Satz von Avogadro bei Ammoniak-Synthese.svg]] | |||
Bei der Entstehung von Ammoniak verringert sich das Volumen, daher hilft erhöhter Druck bei der Synthese. | |||
</div> | |||
<div class="width-1-3"><center>[[Datei:Ammoniak Reaktor BASF.jpg|200px]]</center> | |||
''Der erste Ammoniak-Reaktor, der bei BASF eingesetzt wurde. Wegen dem großen Volumen muss man viel Druck verwenden, um die Atome zu dem einen Molekül zu verbinden! Daher muss der Reaktor sehr stabil sein.'' | |||
</div> | |||
</div> | |||
==Übungen zum Satz von Avogadro== | |||
Übungen zum Satz von Avogadro haben immer mit Volumenverhältnissen zu tun. Dabei hat man meist keine bestimmte Anzahl an Teilchen - wie in den Darstellungen zu sehen ist - sondern es geht um Volumen und Vielfache davon. Das gilt aber nur für gasförmige Stoffe. Wir können natürlich nicht die Volumen von gasförmigen Stoffen und flüssigen Stoffen vergleichen, aber auch flüssige Stoffe untereinander können wir nicht vergleichen, denn es gibt keinen vergleichbaren Satz für Flüssigkeiten, wie den Satz von Avogadro. | |||
'''TIPP:''' Notiere immer die ausgeglichene Reaktionsgleichung die für die Reaktion | |||
{{Box|AUFGABE 1 - Verständnisfrage|2= | |||
Warum braucht man hier, wenn man den Satz von Avogadro anwenden will, auch eine ausgeglichene Reaktionsgleichung? Wir rechnen doch gar nicht mit Massenverhältnissen? ''Erkläre es zum Beispiel an Ammoniak-Synthese.'' | |||
{{Lösung versteckt| | |||
{{Box|LÖSUNG - AUFGABE 1|2= | |||
Eine ausgeglichene Reaktionsgleichung gibt an, wieviele Moleküle/Teilchen miteinander reagieren. Beim Ammoniak zum Beispiel weiß man, dass ein Stickstoff-Molekül mit drei Wasserstoff-Molekülen reagieren. | |||
Aufgrund des "Satzes von Avogadro" kann man von einzelnen Molekülen/Teilchen auf Volumina schließen. Beim Ammoniak reagieren ein Stickstoff-Molekül mit drei Wasserstoff-Molekülen und daher würde zum Beispiel (theoretisch) auch 1 Liter Stickstoff mit drei Liter Wasserstoff reagieren. Oder allgemein: man braucht die dreifache Menge an Wasserstoff wie an Stickstoff. | |||
|3=Lösung}}}}|3=Üben}} | |||
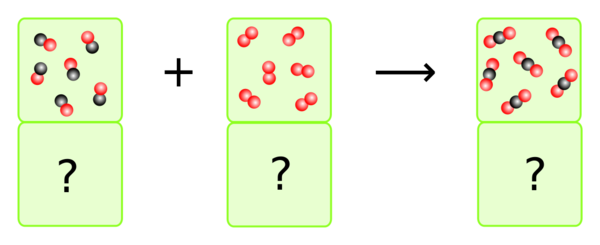
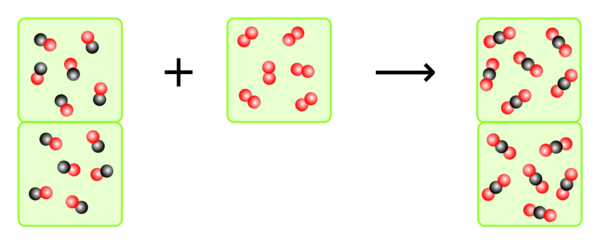
{{Box|AUFGABE 2 - Verbrennung von Kohlenmonoxid|2= | |||
In welchem Verhältnis müssen Kohlenmonoxid und Sauerstoff zusammenkommen, damit das ganze Kohlenmonoxid zu Kohlendioxid verbrennt? | |||
<center>[[Datei:Satz von Avogadro bei Verbrennung von Kohlenmonoxid - Aufgabe.svg|600px]]</center> | |||
{{Lösung versteckt| | |||
{{Box|LÖSUNG - AUFGABE 2|2=<center>[[Datei:Satz von Avogadro bei Verbrennung von Kohlenmonoxid - Lösung.svg|600px]]</center> | |||
Wenn man zählt und entsprechend die Volumen anpasst, sieht man, dass 2 VE Kohlenmonoxid auf 1 VE Sauerstoff kommen. | |||
Dazu kann man aber auch einfach die Reaktionsgleichung betrachten, denn die Anzahl der Teilchen, die miteinander reagieren, entspricht der Anzahl der Volumeneinheiten, die miteinander reagieren müssen. | |||
<math>2 \; CO \; +\; O_2\; \longrightarrow \;2\; CO_2</math> | |||
|3=Lösung}}}}|3=Üben}} | |||
{{Box|AUFGABE 3 - Verbrennung von Methan|2= | |||
# In welchem Verhältnis reagieren die gasförmigen Stoffe bei der Verbrennung von Methan miteinander. | |||
# Was passiert, wenn bei den Edukten das Verhältnis nicht stimmt? Welche zwei Möglichkeiten gibt es da? | |||
{{Lösung versteckt|{{Box|LÖSUNG - AUFGABE 3|2= | |||
<center>[[Datei:Satz von Avogadro bei Verbrennung von Methan - Lösung.svg|100%]]</center> | |||
# Auf eine Volumeneinheit Methan müssen zwei Volumeneinheiten Sauerstoff kommen. Daraus entsteht eine Volumeneinheit Kohlendioxid. Wasser ist flüssig und daher spielt das Volumen keinen Rolle. Zwar ist das Wasser zuerst gasförmig, da es aber erhitzt ist (exotherme Reaktion), ist das Volumen größer, da sich Gase bzw. allgemein Stoffe, beim Erhitzen ausdehnen. | |||
# Ist zu wenig Sauerstoff vorhanden, wird das giftige Kohlenmonoxid entstehen, da nicht genügend Sauertoffatome vorhanden sind, um Kohlendioxid zu bilden. '''Das sollte auf alle Fälle immer vermieden werden!''' Ist zuviel Sauerstoff vorhanden, so kann es bei einem zu großen Überschuss dazu kommen, dass das Methan gar nicht reagieren kann. Dazu gibt es eine Grenze, die man "untere Explosionsgrenze" nennt. Bei einem kleinen Überschuss ist das aber kein Problem. | |||
:Beim Gasbrenner kann das übrigens nicht passieren, dass Kohlenmonoxid entsteht, denn auch bei geschlossener Luftzufuhr ist um die Flamme herum genügend Sauerstoff für eine vollständige Verbrennung vorhanden. Da der Sauerstoff aber nicht mit dem Methan-Gas vermischt ist, brennt die Flamme nicht so heiß. | |||
Wie auch bei der letzten Aufgaben muss man nicht alles zeichnen sondern kann sich auf die ausgeglichene Reaktionsgleichung beschränken. | |||
<math>CH_4 \; + \; 2\; O_2\; \longrightarrow \; CO_2 \; +\; 2\; H_2O </math> | |||
|3=Lösung}}}}|3=Üben}} | |||
{{Box|AUFGABE 4 - Stickstoffdioxid und Distickstofftetraoxid|2= | |||
[[File:Diossido di azoto.jpg|right|250px]]Stickstoffdioxid NO<sub>2</sub> und Distickstofftetraoxid N<sub>2</sub>O<sub>4</sub> sind zwei Stickstoff-Verbindungen, die leicht ineinander übergehen können. Stickstoffdioxid hat eine braune Farbe ''(siehe Bild rechts)'' , während Distickstofftetraoxid farblos ist. | |||
Hat man das braune Stickstoffdioxid in einer geschlossenen Spritze und erhöht man den Druck, so wird das Gas in der Spritze heller. Kannst du das erklären? | |||
{{Lösung versteckt| | |||
{{Box|LÖSUNG - AUFGABE 4|2=Da das Distickstofftetraoxid N<sub>2</sub>O<sub>4</sub> weniger Platz im Verhältnis zum Stickstoffdioxid NO<sub>2</sub> braucht, wird die Entstehung von N<sub>2</sub>O<sub>4</sub> begünstigt. | |||
<center>[[Datei:Satz von Avogadro - Lösung Stickstoffoxid Distickstofftetraoxid Gleichgewicht.svg|500px]]</center> | |||
Als Reaktionsgleichung haben wir: | |||
<math>2 \; NO_2\; \longrightarrow \; N_2O_4</math> | |||
|3=Lösung}}}}|3=Üben}} | |||
[[Kategorie:Stöchiometrie]] | [[Kategorie:Stöchiometrie]] | ||
[[Kategorie:Satz von Avogadro]] | [[Kategorie:Satz von Avogadro]] | ||
[[Kategorie: | [[Kategorie:Chemie]] | ||
Aktuelle Version vom 23. April 2022, 16:10 Uhr
Auf → dieser Unterseite kannst du mit Hilfe von recht einfachen Berechnungen die Entdeckung des Satzes von Avogadro nachvollziehen.
Avogadros Überlegungen
Ende des 18. Jahrhunderts hatte man endlich ausreichend gute Waagen, um die Dichte von Gasen zu bestimmen. Dazu gehört auch die zwei Gasarten, die bei der Elektrolyse von Wasser gewonnenen werden, also Sauerstoff und Wasserstoff.
Ein wichtiger Chemiker zur Zeit Avogadros war der Franzose Antoine de Lavoisier![]() . Er stellte fest, dass alle chemischen Stoffe aus den Elementarstoffen, den Elementen, aufgebaut sind. Die damals bekannten Metalle wie Silber, Kupfer, Blei, Zinn wurden von Lavoisier als Elemente eingeordnet. Und diese Elemente konnten mit dem Gas der Luft – Oxygène, also Sauerstoff – Verbindungen eingehen, wodurch zusammengesetzte Stoffe wie Bleioxid, Zinnoxid oder Kupferoxid entstanden. Lavoisier nannte die Stoffe, die wir heute als Elemente bezeichnen würden, als Substances simples (einfache Substanzen), weil sie sich nach Lavoisier nicht weiter mit chemischen Mitteln zerlegbar ließen.
. Er stellte fest, dass alle chemischen Stoffe aus den Elementarstoffen, den Elementen, aufgebaut sind. Die damals bekannten Metalle wie Silber, Kupfer, Blei, Zinn wurden von Lavoisier als Elemente eingeordnet. Und diese Elemente konnten mit dem Gas der Luft – Oxygène, also Sauerstoff – Verbindungen eingehen, wodurch zusammengesetzte Stoffe wie Bleioxid, Zinnoxid oder Kupferoxid entstanden. Lavoisier nannte die Stoffe, die wir heute als Elemente bezeichnen würden, als Substances simples (einfache Substanzen), weil sie sich nach Lavoisier nicht weiter mit chemischen Mitteln zerlegbar ließen.
Bei einigen Stoffen war also klar, ob sie Elemente und Verbindungen waren. Aber nicht bei allen! So fragten sich die Chemiker damals, woran man erkennen kann, ob ein Stoff jetzt eine Element oder eine Verbindung ist? Die Gase waren dabei der Schlüssel zur Bestimmung der Elemente.
Da sich Sauerstoff und Wasserstoff von Wasserdampf unterschieden, musste das Wasser, das ja bei einer Knallgasexplosion aus Sauerstoff und Wasserstoff entstand, ein zusammengesetzter Stoff sein.
Avogadro leitete sein Gesetz aus den von Gay-Lussac gefundenen gesetzmäßigen Beziehungen bei gasförmigen Stoffen ab.
1. Gesetz: Der Quotient aus Volumen und Temperatur bei einem Gas ist bei gleichbleibender Menge und Druck gleich:
2. Gesetz: Der Druck von Gasen ist bei gleichbleibendem Volumen und gleichbleibender Teilchenanzahl direkt proportional zur Temperatur, weswegen der Quotient gleich bleibt.
Daraus folgerte Avogadro seinen Satz, wobei er auch Begriffe wie molécules élémentaires (Atome) und molécules intégrantes (Moleküle) verwendete, sein Gesetz galt aber auch Gasgemische. Bei seinen Überlegungen nahm Avogadro an, dass auch die Elemente zusammengesetzt sein können. Denn jedes Molekül eines Elementes in der Gasphase sollte aus zwei Atomen des Elementes bestehen, was wir ja von Sauerstoff O2, Stickstoff N2, Wasserstoff H2 usw. kennen. Die einatomigen Edelgase waren damals noch nicht bekannt.
Die Idee Avogadros war nicht unumstritten, denn einige Chemiker waren der Meinung, dass die von ihm quasi eingeführten "Moleküle" aus mindestens 8 Atomen bestehen müssten. Dies konnte aber widerlegt werden. Stattdessen wurde mit Hilfe der Dichte von Gasen und dem "Satz von Avogadro" durch Jean Baptiste Dumas die Molekülmassen einer Vielzahl von gasförmigen Stoffen bestimmt und Charles Frédéric Gerhardt formulierte mit Hilfe der Dichte und den Molekülmassen die Formeln für Chlorwasserstoff, Wasser, Ammoniak, Kohlenstoffdioxid. Dabei ergaben sich allerdings Widersprüche zu den Atommassen, die von Berzelius in einer erste Liste mit Elementen und den von ihm erfundenen Symbolen, aufgestellt worden sind.
Es folgten viele weitere Experimente und Untersuchungen an Gasen und erst ein halbes Jahrhundert später nach ihrer ersten Formulierung gelangten Avogadros Ansichten wirklich zur Geltung. Avogadros Gesetz war damit von großer Bedeutung, insbesondere für die Chemie. Es ist aber auch für die Physik bedeutend, vor allem für die kinetische Gastheorie, die von James Clerk Maxwell weiterentwickelt wurde. Der Satz von Avogadro ist auch – wenn auch versteckt – in der allgemeinen Gasgleichung enthalten.
Der Satz von Avogadro
Das Gesetz von Avogadro sagt aus, dass zwei gleich große Gasvolumina, die unter demselben Druck stehen und die dieselbe Temperatur haben, auch dieselbe Teilchenanzahl einschließen. Dies gilt sogar dann, wenn die Volumina verschiedene Gasarten gemischt enthalten. Umgekehrt kann man daraus schließen, dass ein Gaspaket in einem bestimmten Volumen auch eine bestimmte Anzahl von Teilchen hat, die unabhängig von der Stoffart ist.
Für was ist der Satz von Avogadro wichtig?
Die Chemiker im 19. Jahrhundert haben den Satz von Avogadro mit Hilfe von einigen Beobachtungen "gefunden". Umgekehrt können wir diesem Satz nun auch nutzen und einige Phänomene und Beobachtungen erklären. Also von Volumina auf die Anzahl der Teilchen und damit auf mögliche Formeln von Verbindungen schließen.
- Bei der Elektrolye von Wasser entstehen Wasserstoff und Sauerstoff immer im Volumen-Verhältnis 2 zu 1. Daraus kann man die Formel von Wasser herleiten, wenn man den Satz von Avogadro kennt.
Wir wissen auch, in welchen Volumina gasförmige Verbindungen miteinander reagieren.
- Zur Herstellung von Ammoniak braucht man Wasserstoff und Stickstoff. Denn die Formel von Ammoniak ist NH3 und somit braucht man ein dreimal so großes Volumen an Wasserstoff wie an Stickstoff.
Bei der Entstehung von Ammoniak verringert sich das Volumen, daher hilft erhöhter Druck bei der Synthese.
Übungen zum Satz von Avogadro
Übungen zum Satz von Avogadro haben immer mit Volumenverhältnissen zu tun. Dabei hat man meist keine bestimmte Anzahl an Teilchen - wie in den Darstellungen zu sehen ist - sondern es geht um Volumen und Vielfache davon. Das gilt aber nur für gasförmige Stoffe. Wir können natürlich nicht die Volumen von gasförmigen Stoffen und flüssigen Stoffen vergleichen, aber auch flüssige Stoffe untereinander können wir nicht vergleichen, denn es gibt keinen vergleichbaren Satz für Flüssigkeiten, wie den Satz von Avogadro.
TIPP: Notiere immer die ausgeglichene Reaktionsgleichung die für die Reaktion
Warum braucht man hier, wenn man den Satz von Avogadro anwenden will, auch eine ausgeglichene Reaktionsgleichung? Wir rechnen doch gar nicht mit Massenverhältnissen? Erkläre es zum Beispiel an Ammoniak-Synthese.
Eine ausgeglichene Reaktionsgleichung gibt an, wieviele Moleküle/Teilchen miteinander reagieren. Beim Ammoniak zum Beispiel weiß man, dass ein Stickstoff-Molekül mit drei Wasserstoff-Molekülen reagieren.
Aufgrund des "Satzes von Avogadro" kann man von einzelnen Molekülen/Teilchen auf Volumina schließen. Beim Ammoniak reagieren ein Stickstoff-Molekül mit drei Wasserstoff-Molekülen und daher würde zum Beispiel (theoretisch) auch 1 Liter Stickstoff mit drei Liter Wasserstoff reagieren. Oder allgemein: man braucht die dreifache Menge an Wasserstoff wie an Stickstoff.
In welchem Verhältnis müssen Kohlenmonoxid und Sauerstoff zusammenkommen, damit das ganze Kohlenmonoxid zu Kohlendioxid verbrennt?
Wenn man zählt und entsprechend die Volumen anpasst, sieht man, dass 2 VE Kohlenmonoxid auf 1 VE Sauerstoff kommen.
Dazu kann man aber auch einfach die Reaktionsgleichung betrachten, denn die Anzahl der Teilchen, die miteinander reagieren, entspricht der Anzahl der Volumeneinheiten, die miteinander reagieren müssen.
- In welchem Verhältnis reagieren die gasförmigen Stoffe bei der Verbrennung von Methan miteinander.
- Was passiert, wenn bei den Edukten das Verhältnis nicht stimmt? Welche zwei Möglichkeiten gibt es da?
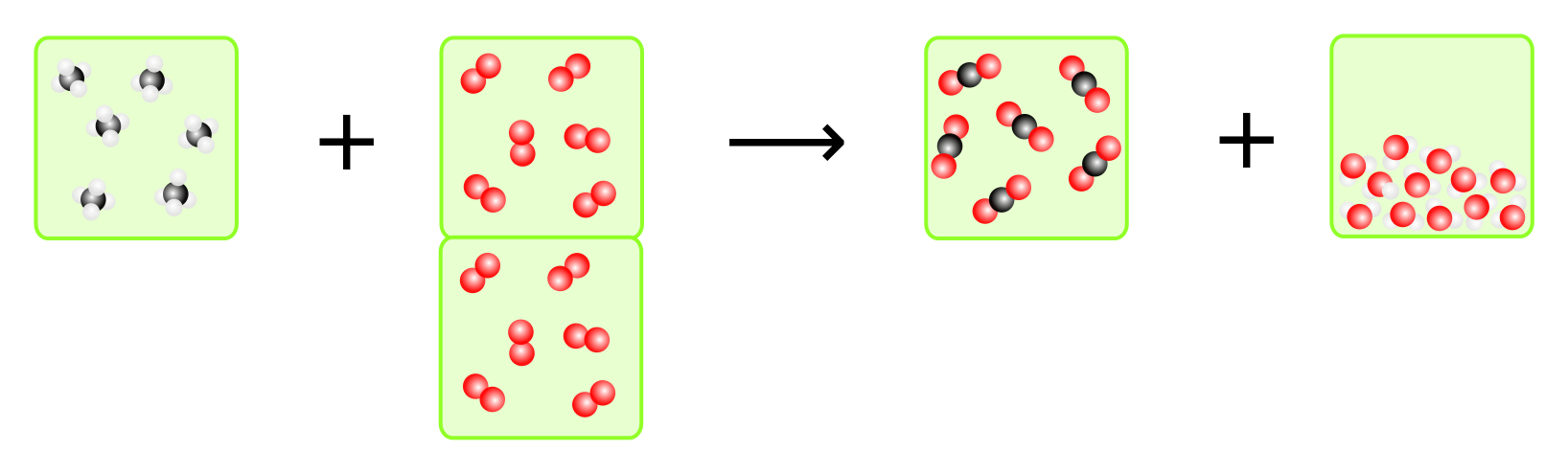
- Auf eine Volumeneinheit Methan müssen zwei Volumeneinheiten Sauerstoff kommen. Daraus entsteht eine Volumeneinheit Kohlendioxid. Wasser ist flüssig und daher spielt das Volumen keinen Rolle. Zwar ist das Wasser zuerst gasförmig, da es aber erhitzt ist (exotherme Reaktion), ist das Volumen größer, da sich Gase bzw. allgemein Stoffe, beim Erhitzen ausdehnen.
- Ist zu wenig Sauerstoff vorhanden, wird das giftige Kohlenmonoxid entstehen, da nicht genügend Sauertoffatome vorhanden sind, um Kohlendioxid zu bilden. Das sollte auf alle Fälle immer vermieden werden! Ist zuviel Sauerstoff vorhanden, so kann es bei einem zu großen Überschuss dazu kommen, dass das Methan gar nicht reagieren kann. Dazu gibt es eine Grenze, die man "untere Explosionsgrenze" nennt. Bei einem kleinen Überschuss ist das aber kein Problem.
- Beim Gasbrenner kann das übrigens nicht passieren, dass Kohlenmonoxid entsteht, denn auch bei geschlossener Luftzufuhr ist um die Flamme herum genügend Sauerstoff für eine vollständige Verbrennung vorhanden. Da der Sauerstoff aber nicht mit dem Methan-Gas vermischt ist, brennt die Flamme nicht so heiß.
Wie auch bei der letzten Aufgaben muss man nicht alles zeichnen sondern kann sich auf die ausgeglichene Reaktionsgleichung beschränken.
Hat man das braune Stickstoffdioxid in einer geschlossenen Spritze und erhöht man den Druck, so wird das Gas in der Spritze heller. Kannst du das erklären?