Nachricht für neue Nutzer.
Nachricht für engagierte Nutzer.
Oberstufen-Chemiebuch Kontextorientiert/Der Griff nach den Sternen - chemisch betrachtet!
Warum wissen wir eigentlich so viel von den Sternen? Es war doch noch nicht jemand außerhalb des Sonnensystems!
Was bei uns ankommt!
Ja, im Grund genommen wissen wir nur das, was bei uns ankommt ... und das ist das Licht der Sterne. Doch genau das kann helfen zu erfahren, welche Elemente dort in den Weiten zu finden sind.
Was uns als weißes Licht erscheint ist ja ein Gemisch aus sichtbaren elektromagnetischen Wellen verschiedener Wellenlänge. Wie stark das Licht gebrochen wir hängt von dem Wellenlänge ab und so kann man mit Hilfe des Prisma die "Bestandteile" des weißen Licht erkennen.
Den Prismen-Effekt als Hilfsmittel für analytische Zwecke erfand der deutschen Optiker Joseph von FraunhoferDie hauptsächliche Leistung Fraunhofers bestand darin, dass er sehr akribisch und wissenschaftlich genau bei seinen Forschungen vorgegangen ist und so die schon vorhandenen sogenannten Achromatischen Objektive, die einen sonst typischen Farbfehler bei Linsen vermieden, perfektionierte. Er begründete damit Anfang des 19. Jahrhunderts den Fernrohrbau für die Wissenschaft.
1858 entwickelten die Deutschen Gustav Kirchhoff und Robert Bunsen die Idee weiter zur Spektralanalyse. Die weiter fortschreitende Verbesserung der Geräte und Methoden, wie auch die Nutzung weiterer Frequenzbereiche außer dem sichtbaren Licht, mündete 1925 in die Bestimmung der Entfernung des Andromedanebels durch Edwin Hubble, nach dem heute ein Weltraumteleskop benannt ist.
Was steckt chemisch dahinter?
Das Bohrsche Atommodell wurde 1913 von Niels Bohr entwickelt. Atome bestehen bei diesem Modell aus einem schweren, positiv geladenen Atomkern und leichten, negativ geladenen Elektronen, die den Atomkern auf geschlossenen Bahnen umkreisen. Anders als ältere Atommodelle zeigt das Bohrsche Atommodell viele der am Wasserstoffatom beobachteten Eigenschaften.
Die Vorgeschichte zur Entwicklung des Bohrschen Atommodells ist die Entdeckung der Spektrallinien beim Wasserstoff-Atom in der ersten Hälfte des 19. Jahrhunderts. Das folgende Bild den sichtbarer Bereich des Wasserstoff-Spektrums sowie einen Teil aus dem ultravioletten Teil des Spektrums, da der Sensor der Kamera diesen Bereich auch emfangen kann.

Für die Position der Linien innerhalb der jeweiligen Serie konnten Johann Jakob Balmer und Johannes Rydberg anhand von gemessenen Linienspektren bereits 1885 und 1888 numerische Formeln angeben. Der physikalische Hintergrund dieser Formeln blieb jedoch fast dreißig Jahre lang ein Rätsel.
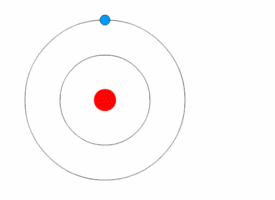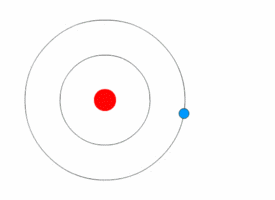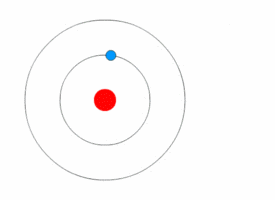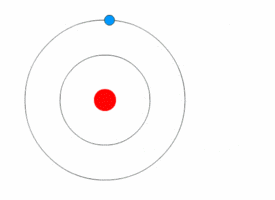
Mit Hilfe des Bohrschen Atommodells konnte man dann erklären, wie es zur Aussendung von Licht mit einem speziellen Frequenz und damit Energie kommt. Wechselt, wie in den Bilder unten dargestellt, ein einzelnes Elektron von auf eine niedrigere Kreisbahn, so es wird ein Photon mit einer Frequenz ausgesendet, die dem Energieunterschied zwischen den beiden Bahnen entspricht.
Beim Wasserstoffatom ergeben sich dann folgende Energieübergänge, die bestimmten Folgen von Spektrallinien im elektromagnetischen Spektrum des Wasserstoffatoms führen. Eine Serie entspricht dabei den Übergängen von Elektronen höherer Niveaus auf das gleiche Grundniveau. Für verschiedene höhere Niveaus erhält man eine höhere Energiedifferenz und damit Photonen höherer Energie, also höherer Frequenz. Im rechten Bild sind die Übergänge im Atommodell dargestellt mit der Angabe der Wellenlängen.
Damit können wir genauer definieren ...
| Eine Spektrallinie ist das Licht einer genau definierten Frequenz, das von einem Atom oder Molekül aufgrund des Übergangs eines Elektron zwischen zwei Schalen abgegeben oder absorbiert (aufgenommen) wird. Es dient der Unterscheidung unterschiedlicher Atomsorten. Die Frequenz (und damit die Farbe) einer Spektrallinie wird durch die Energie des emittierten oder absorbierten Photons bestimmt, die gerade den Unterschied zwischen den Energien der Schalen bestimmt.
|
Wiederholung des Bohrschen Atommodells
Suche die wichtigsten Informationen zum Schalenmodell (= Bohr'sches Atommodell) heraus und halte folgende Informationen fest:
- Wieviele Elektronen passen auf welche Schale? Und warum ist die Anzahl verschieden?
- Wie erfolgt die Verteilung der Elektronen auf die Schalen? Welche Rolle spielt da die Oktett-Regel?
- Welche Informationen zum Schalenmodell kann man aus dem Periodensystem ablesen?
- Wo spielt das Schalenmodell bei der Bildung von Ionen bzw. bei Atombindungen einen Rolle?
Bild mit farbigen Zellen nach Schalen
Ergänzend noch ein paar Informationen, denn das Bohrsche Atommodell hat eigentlich ein paar Schwächen.
Wichtig für das Funktionieren dieser Modell ist die Bewegung der Elektronen um den Kern. Würden die Elektronen sich nicht bewegen, würden die negativen Elektronen vom positiven Kern angezogen werden und das Atom in sich zusammenstürzen. Nur durch die Fliehkraft wird die Anziehung aufgehoben.
Wenn sich die Elektronen um den Kern bewegen, findet aufgrund der Kreisbewegung immer eine beschleunigte Bewegung statt. Beschleunigte Ladungen strahlen aber elektromagnetische Wellen ab. Nach dem Energierhaltungssatz muss mit der Abstrahlung ein Energieverlust des Elektrons verbunden sein, was zu einer Verringerung der Geschwindigkeit führt. Die wiederum führt dazu, dass im Rutherfordschen Atommodell das Elektron nach sehr kurzer Zeit auf Spiralbahnen in den Atomkern stürzt.
Bohr beseitigte dieses Problem, indem er postulierte, dass sich die Elektronen im Rutherfordschen Modell nur auf bestimmten diskreten Bahnen bewegen können, die stationär genannt werden. Auf diesen stationären Bahnen strahlt das Elektron einfach keine Energie ab. Bohr setzte mit diesem Postulat die Grundlagen der klassischen Mechanik und Elektrodynamik außer Kraft und machte dies ganz bewusst, denn er konnte für sein Modell keine Begründung auf der Grundlage des klassischen Physik finden. Allerdings konnten man mit Hilfe des Modells die Lage der Spektrallinien erklären, weswegen sich das Bohr'sche Atommodell durchaus rechtfertigten lies.
Im Grunde genommen lag Bohr damit richtig, denn letztendlich war es die endgültige Abkehr von der klassischen Physik, mit der Formulierung der Quantenmechanik durch Heisenberg, Schrödinger und anderen Physikern, mit der man dann schließlich alle Widersprüche erklären konnte. Damit werden wir uns aber erst später beschäftigen!
Informationen aus dem Himmel
Als kleines Schmankerl schauen wir uns noch ein paar Bilder aus dem Weltall an, die freundlicherweise größtenteils von der NASA zur freien Verfügung gestellt werden. Als staatlich finanziertes Unternehmen muss seine Bilder nämlich öffentlich machen.
Bilder von Sternen und Galaxien
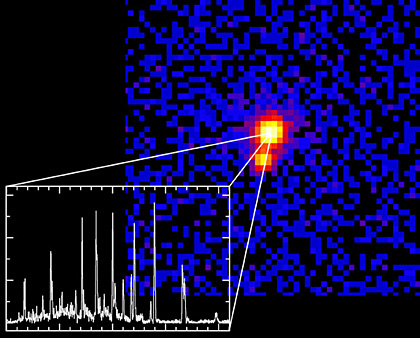
Leider stehen bei dieser Spektroskopie keine Informationen dabei. Bei dem folgenden Bild aber wurde beschriftet, welcher Peak was bedeutet.
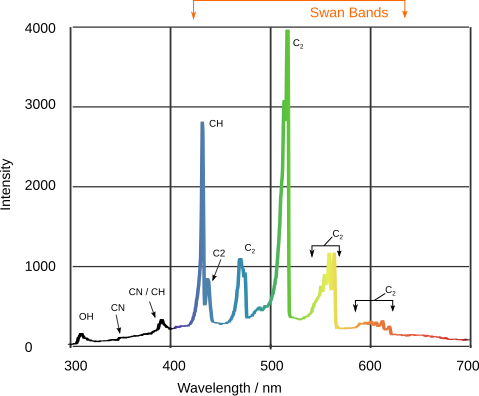
Die Spitzen entsprechen im Vis-Spektrum den farbigen Linien und links eines Teils des Infrarotspektrums. Auch die Höhen der PEaks spielen eine Rollen, denn je mehr da ist, um so höher ist der Peak. Das Spektrum zeigt übrigens nicht das Spektrum des Licht eines Sterns sonder von einem Gasbrenner mit Butan-Gas.
Bewegungen im Weltall entdecken
Immer noch ist das Universum dabei, sich weiter auszudehnen. Die Entfernungen zu den beobachteten Sternen ist aber so groß, dass man die Bewegungen an sich nicht wahrnehmen kann. Aber auch hier kann ein Spektrum helfen. Dabei geht es um den sogenannten Doppler-Effekt, den man zum Beispiel von der Veränderung des Tones eines Martinshornes kennt, wenn ein Rettungswagen an einem vorbeifährt.
Durch die Bewegung kommt es zu einer Stauchung bzw. Dehnung der Wellen des Signals, wenn sich das Signal auf einen zubewegt bzw. entfernt. Durch die veränderte Wellenlänge, hören sich die Töne anders an.
Gleiches passiert mit den Wellen des Lichts. Bewegt sich eine Lichtquelle vom Beobachter weg, so findet eine Rotverschiebung statt, da sich die Elektromagnetischen Wellen des Lichtes verlängern und somit die Farbe sich in Richtung des roten Lichts verschiebt. Bewegt sich umgekehrt eine Lichtquelle auf den Beobachter zu, so verkürzen sich die Wellenlängen und die Farbe verschiebt sich in Richtung des blauen Lichts.
Neuer Planet mit Atmosphäre entdeckt?
Seit einigen Jahren gibt es eine solche Meldung immer wieder: mal wieder wurde ein neuer Extra Solarer Planet entdeckt (oder kürzer: Exoplanet).
Im Februar 2017 meldete die NASA, dass man "nur" 40 Lichtjahre entfernt im Sternensystem Trappist-1 sieben erdähnliche Planeten gefunden hat. Von denen liegen mindestens drei Stück in der sogenannten habitablen Zone, wo also für Menschen aufgrund der Temperaturen vermutlich akzeptable Bedingungen dürften. Wichtig ist, dass Wasser dort flüssig existiert, zu nah am Stern wäre es gasförmig, zu weit weg würde das Wasser gefrieren.

Bei Trappist-1 a handelt es sich um einen sehr kleinen und leuchtschwachen roten Zwergstern. Er besitzt nur etwa ein Zwölftel der Masse und ein Neuntel des Durchmessers der Sonne. Da Rote Zwerge weitaus älter werden als sonnenähnliche Sterne, hätte Leben auf Planeten, wie die um Trappist-1, wesentlich mehr Zeit, sich zu entwickeln. Das Sternensystem von Trappist-1 und vergleichbare Systeme werden von Astronomen als vielversprechendste Kandidaten für mögliches außerirdisches Leben bezeichnet.

Wie entdeckt man solche Planeten
Im Gegensatz zu Sternen, die selber leuchten, werden Planeten ja nur angestrahlt. Dieses Licht ist aber viel zu schwach, um es aus der Ferne wahrzunehmen. Daher konnte man Exoplaneten bisher nur indirekt nachweisen. Dafür gibt es mehrere Methoden, bei denen man den Einfluss der Planeten auf den Stern nachweist.
Etwa 80% der bisher gefundenen Exoplaneten wurden mit der Transitmethode entdeckt. Der Planet wird dabei nicht direkt beobachtet, sondern nur indirekt durch Beobachtung des Helligkeitsverlaufs seines Sterns nachgewiesen. Vereinfacht gesagt: der Planet, der vor dem Stern vorbeifliegt, verdunkelt ihn ein wenig. Außerdem erhält man Daten über die Atmosphäre der Planeten, da sich das Sternlicht-Spektrum während des Sterndurchgangs des Planeten verändert. Dabei wird ein Teil der Strahlung von Molekülen der Atmosphäre absorbiert. So hat man bei den Planeten Trappist-1-b und Trappist-1-c eine wolkenfreie, wasserstoffbasierte Atmosphäre nachweisen können.
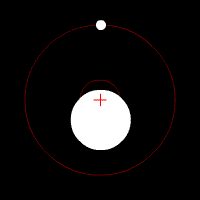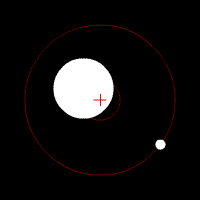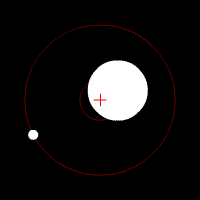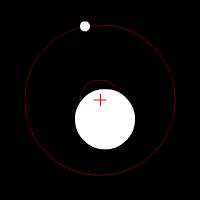
Zwei weitere Methoden, die einigermaßen leicht zu verstehen sind, beruhen auf der Tatsache, das Stern und Planet sich unter dem Einfluss der Gravitation um ihren gemeinsamen Schwerpunkt bewegen.
Die leichte Kreisbewegung des Sternes lässt sich mit der, durch den Doppler-Effekt verursachten, Blau- und Rotverschiebung nachweisen. Genauso kann man beim Stern, von der Ferne betrachtet, eine leichtes Hin- und Herbewegung im Vergleich zu den umgebenden Sternen erkennen, was aber erst seit kurzem möglich ist, da alte Teleskope nicht genau genug waren.