Nachricht für neue Nutzer.
Nachricht für engagierte Nutzer.
Chemische Reaktionen/Energie bei chemischen Reaktionen
Aus ZUM-Unterrichten
Experimente
Aufgabe 1
Notiere zu jedem Versuchsteil in deinen Unterlagen die benötigten Geräte und Chemiekalien, die Durchführung sowie eine Skizze zum Aufbau. Lasse deine Vorüberlegungen von der Lehrkraft abnhemen und führe den Versuchsteil anschließend durch. Formuliere jeweils eine Wortgleichung für die abgelaufene Reaktion.
Versuchsteil 1
Fülle ein Reagenzglas ca. 1 cm hoch mit blauem Kupfersulfat. Spanne das Reagenzglas in ein Stativ ein und erhitze es mit der rauschenden Flamme, bis eine Farbveränderung eintritt. Beende dann sofort das Erhitzen!
Versuchsteil 2
Warte, bis der Aufbau aus dem ersten Teil abgekühlt ist. Umfasse nun den unteren Teil des Reagenzglases mit einer Hand und gib wenige Tropfen dest. Wasser hinzu.
Hintergrundinformationen
Aufgabe 2
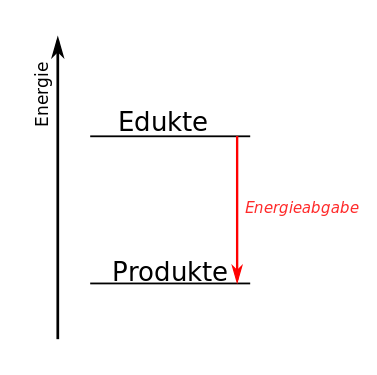
Lies die folgenden Informationen. Entscheide begründet für jeden der oben beschriebenen Versuche, ob es sich um eine exotherme oder eine endotherme Reaktion handelt und skizziere ein passendes Energiediagramm, in dem du statt „Produkte” und „Edukte” die Bezeichnungen aus der Wortgleichung zur jeweiligen Reaktion einfügst.
Energie bei chemischen Reaktionen
In Zusammenhang mit chemischen Reaktionen spielt der Aspekt der Energie eine wichtige Rolle. Dabei unterscheiden wir endotherme und exotherme Reaktionen.
| Endotherme Vorgänge | Exotherme Vorgänge |
| Bei einem endothermen Vorgang nehmen Substanzen Energie auf. Das bedeutet, dass ihnen Energie zugeführt werden muss. Endotherme Vorgänge erkennt man z.B. daran, dass sich ein Gemisch währenddessen von selbst abkühlt oder dass ein Reaktionsgemisch permanent erhitzt werden muss, damit die Reaktion weiterläuft. | Bei einem exothermen Vorgang wird Energie an die Umgebung abgegeben. Das erkennt man z.B. daran, dass sich ein Gemisch während des Vorgangs ohne weiteres Erhitzen von selbst erwärmt oder dass eine Flamme zu sehen ist. |
| Das Energiediagramm einer endothermen Reaktion sieht so aus: | Das Energiediagramm einer exothermen Reaktion sieht so aus: |