Chemie-Lexikon/Energie bei chemischen Reaktionen
Wenn wir uns mit der Energie bei chemischen Reaktionen beschäftigen wollen, dass muss eine wichtige Grundlage zuerst angesprochen werden.
Der Energieerhaltungssatz ist eines der wichtigsten Grundlagen der Naturwissenschaften, auch für die Betrachtung der Energie bei chemischen Reaktionen. Es gab schon 1842 erste Experimente dazu, aber endgültig ausformuliert wurde dieser Satz 1847 von Hermann von Helmholtz. Auch wenn es im Laufe der Jahre immer wieder Zweifler gab, so gilt der Energieerhaltungssatz inzwischen als etabliert und gesichert.
Dieser Energieerhaltungs-Satz muss natürlich auch bei chemischen Reaktionen gelten, wenn scheinbar Energie beim Verbrennen von Holz erzeugt wird. Man sagt deshalb, dass Stoffe eine besondere Art an Energie haben, die man als chemische Energie bezeichnet. Wenn bei einer chemischen Reaktion Energie frei wird, dann wird chemische Energie in eine andere Energieform, wie zum Beispiel in Wärme- und Lichtenergie, umgewandelt.
Wichtig zu wissen ist, dass man nicht eine Stoffportion betrachten und dann deren chemischen Energieinhalt genau bestimmen kann. Vielmehr sehen wir nur, wenn sich der Energieinhalt verändert, was dann bei chemischen Reaktionen messbar ist, wenn man zum Beispiel bestimmt, welche Menge an Wärmeenergie gewonnen werden kann.
Ein praktische Anwendung ist die Bestimmung der enthaltenen Kalorien (Kcal) einer Nahrungsmittelportion, die in einem sogenannten Bombenkaloriemeter bestimmt werden. Dabei wird Wasser erhitzt und man kann aus der Temperaturänderung der freiwerdende Energiemenge bestimmen.
Reaktionen, bei denen Energie frei wird
Als exotherm (griechisch ἔξω exo ,außen‘ und θερμός thermós ,warm‘, ,heiß‘, ,hitzig‘) bezeichnet man eine chemische Reaktion, wenn deren Produkte einen geringeren Energiegehalt haben als die Ausgangsstoffe. Gelegentlich werden exotherme Reaktionen auch pauschal definiert als Reaktionen, bei denen Wärme abgeben wird.
Betrachten wir eine solche exotherme Reaktion im Video:
Man sieht, dass bei der Energie frei wird, denn nach dem Anzünden mit einem heißen Glasstab sieht man, dass das Gemisch aus Schwefel und Zink zu Brennen anfängt und sich ein Glühen durch das Gemisch hindurchzieht. Dieses Glühen wird nicht durch den Glasstab hervorgerufen sondern durch die Energie, die bei der chemischen Reaktion frei wird. Und wzar ist das hier die folgende Reaktion:
In einem Energiediagramm kann man diese Reaktion so darstellen:

In dem einfachen Energie-Diagramm gibt es nur eine Achse. Diese senkrechte Achse steht für den Energiegehalt. Der Pfeil zeigt an, dass in dieser Richtung die in einem Stoff enthaltene Energiemenge zunimmt. Es gibt im Gegensatz zu den meisten anderen Diagrammen keine absoluten Energieangaben, wie es auch keine Stelle gibt, wo eine Energiemenge von 0 kJ angegeben wird.
Grund ist, dass man nur Unterschiede zwischen den chemischen Energieinhalten bei den Edukten und Produkten feststellen kann, aber niemals einen absoluten Wert.
Der Pfeil zeigt die Reaktionsrichtung an, von den Edukten zu den Produkten.
Mit diesen Informationen kann man nun aus dem einfachen Energiediagramm zu der Reaktion von Eisen und Schwefel zu Eisenoxid ablesen, dass die chemische Energie in dem Gemisch von Eisen und Schwefel höher ist als die chemische Energie beim Reaktionsprodukt Eisensulfid.
Bei der Reaktion wird ein Teil der chemischen Energie, die in Eisen und Schwefel enthalten ist, in andere Energieformen umgewandelt ist, nämlich - wie im Film zu sehen ist - in Strahlungs- und Wärmeenergie (das Produkt glüht!).
Bei einer exothermen Reaktion wird Energie z.B. in Form von Wärme frei. Dabei wird die (innere, unsichtbare) chemische Energie in (wahrnehmbare) Wärmeenergie umgewandelt. Bei diese Umwandlung entstehen Stoffe mit einem geringeren Energieinhalt.
Die freiwerdende Energie wird nicht neu geschaffen!Vergleicht man die exotherme Reaktion von Eisen mit Schwefel mit ähnliches Reaktionen, so stellt man fest, dass die Mengen an freiwerdender Energie nicht identisch sind. Hier die Reaktion von Kupfer mit Schwefel:
Auch diese Reaktion ist exotherm, denn die freiwerdende Energie ist durch das Glühen des Kupferbleches erkennbar. Allerdings sieht man deutlich, dass bei der Reaktion von Eisen mit Schwefel wesentlich mehr Energie frei wird. Vergleicht man nun die Energiediagramme, so kann man den bei der Reaktion so verdeutlichen.

Wichtig zu verstehen ist, dass die Höhe der beiden Ausgangs-Gemische kein Vergleich erlauben soll. Vielmehr geht es auch wiederrum nur um den Höhenunterschied innerhalb des Diagramms. Da bei der Reaktion von Kupfer mit Schwefel weniger Energie als bei der Reaktion von Eisen mit Schwefel frei wird, darf der Unterschied bei den Edukten und dem jeweiligen Produkt nicht identisch sein.
Allgemein sieht ein einfaches Energie-Diagramm für eine exotherme folgendermaßen aus:

Mit folgenden Experimenten hast du dich zum Thema Energie beschäftigt. Schau dir deine Notizen an und bei den Video-Experimenten ggf. noch einmal die Videos und zeichne dann Energiediagramme zu allen beobachteten Chemischen Reaktionen (siehe → Seite mit Anleitungen)
- Weißes Kupfersulfat + Wasser ⟶ Blaues Kupfersulfat
- Blaues Kupfersulfat ⟶ Weißes Kupfersulfat + Wasser
- Verschiedenen Metalle mit Schwefel (zusammen in ein Diagramm - nebeneinander)
- Eisen + Schwefel ⟶ Eisensulfid
- Kupfer + Schwefel ⟶ Kupfersulfid
- Zink + Schwefel ⟶ Zinksulfid
- Magnesium + Schwefel ⟶ Magnesiumsulfid
- Verschiedenen Metalle mit Sauerstoff (zusammen in ein Diagramm - nebeneinander)
- Kupfer + Sauerstoff ⟶ Kupferoxid
- Eisen + Sauerstoff ⟶ Eisenoxid
- Magnesium + Sauerstoff ⟶ Magnesiumoxid
Beispiele für alltägliche, exotherme Reaktionen sind:
- Feuer (Verbrennung)
- Abbinden (= Aushärten) von Beton (erwärmt sich messbar, aber ohne Glühen!)
- Rosten von Eisen
Fassen wir nun noch mal den Begriff exotherme Reaktion kurz zusammen.
Exotherm sind chemische Reaktionen ...
- die unter Abgabe von Energie erfolgen
- bei denen die Edukte weniger Energie enthalten als die Produkte
Es erscheint zunächst naheliegend anzunehmen, dass die exothermen Reaktionen gerade diejenigen Reaktionen sind, die freiwillig ablaufen, und dass sie um so heftiger abliefen, je mehr Wärme freigesetzt wird. In vielen Fällen verhalten sich die chemischen Reaktionen auch tatsächlich so. Es gibt aber auch exotherme Reaktionen, bei denen man gar nicht erkennen kann, dass Energie abgegeben wird, weil nur wenig Energie frei wird, wie beim Rosten von Eisen. Ganz freiwillig - also ohne Zutun - laufen aber auch die meisten exotermen Reaktionen nicht ab. Meist bedarf es einer Aktivierungsenergie, die zuerst zugeführt werden muss.
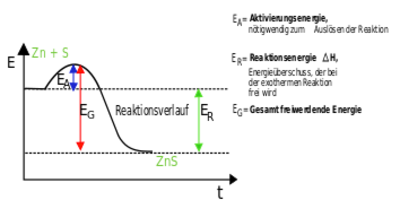
Aktivierungsenergie
Die Aktivierungsenergie ist eine Art Energie-Barriere, die bei einer chemischen Reaktion von den Reaktionspartnern überwunden werden muss.
Allgemein gilt: Je niedriger die Aktivierungsenergie, desto schneller/freiwlliger läuft die Reaktion ab. Im Verlauf einer chemischen Reaktion findet eine Umgruppierung der Atome, von den Edukten hin zu den Produkten statt, wobei alte Verbindungen aufgebrochen und neue Verbindungen geknüpft werden. Die Edukte durchlaufen dabei einen aktivierten Zustand, den sog. Übergangszustand (siehe Abbildung rechts, Kurvenmaximum), dessen Erreichen eine bestimmte Energie (Aktivierungsenergie) erfordert.
...
Katalysator
Katalysator (von der Katalyse – griechisch κατάλυσις katálysis, deutsch ‚Auflösung‘ mit lateinischer Endung) bezeichnet in der Chemie einen Stoff, der die Reaktionsgeschwindigkeit durch die Senkung der Aktivierungsenergie einer chemischen Reaktion erhöht, ohne dabei selbst verbraucht zu werden. Die Menge an freiwerdender Energie bleibt letztendlich aber identisch.
Seit der Antike werden chemische Reaktionen mit Hilfe von Katalysatoren ausgeführt. Erst Jöns Jakob Berzelius kam 1835 zu der Erkenntnis, dass eine Vielzahl von Reaktionen nur erfolgte, wenn ein bestimmter Stoff zugegen war, der jedoch nicht verbraucht wurde. Seiner Meinung nach wurden diese Stoffe nicht umgesetzt, lieferten jedoch durch ihre Anwesenheit die Energie über ihre katalytische Kraft. Er bezeichnete diese Stoffe als Katalysatoren.
Als Definition sollte man sich merken: Ein Katalysator ist ein Stoff, der die Aktivierungsenergie einer Reaktion herabsetzt (er hilft sozusagen über den Energieberg). Er nimmt an der Reaktion teil, geht aber am Ende unverändert aus ihr hervor (er nimmt dann von neuem an der Reaktion teil). Die freiwerdende Reaktionsenergie wird nicht verändert. Dadurch wird die Reaktionsgeschwindigkeit erhöht, es laufen aber auch einige Reaktionen erst dann ab, wenn man eine Katalysator verwendet.
Ein typisches und bekanntes Beispiel ist der Autokatalysator der verhindern soll, dass unverbrannter oder nicht vollständig verbrannter Kraftstoff als Abgas aus dem Auspuff kommt. Hier wird die Reaktion mit Sauerstoff gefördert und so eine vollständige Verbrennung erreicht.
Chemie spielt sich nicht nur im Labor ab, auch im Körper werden Stoffe ineinander umgewandelt. Enzyme haben dabei die Rolle von Katalysatoren, die nicht nur im Körper eine chemische Reaktion beschleunigen. Solche Enzme nutzen wir auch außerhalb unseres Körpers, zum Beispiel:
- Waschmittel enthalten Enzyme, um Eiweiße aufzuspalten, damit Eiweiß-Verunreinigungen besser entfernt werden können.
- Bei der Käseproduktion bewirken Enzyme die Gerinnung der Milch.
- In einer Brauerei wird Stärke aus Getreide und Kartoffeln in Zucker umgewandelt)
Chemische Reaktionen, die unter Zufuhr von Energie ablaufen
Das Gegenteil von einer Exothermen Reaktion ist eine Endotherme Reaktion. Als endotherm werden in der Chemie Reaktionen bezeichnet, bei denen Energie zugeführt werden muss. Eine endotherme Reaktion ist demnach eine Reaktion, bei der Energie, etwa in Form von Wärme, aus der Umgebung aufgenommen wird. Beispiele für endotherme Reaktionen sind die Photosynthese der Pflanzen oder Gewinnung von Wasserstoff in einer Elektrolyse aus Wasser mit Hilfe von Sonnenenergie. Dabei entstehen Stoffe, die einen höheren Energieinhalt haben als die Ausgangsstoffe. In den genannten Beispielen werden dabei Stoffe als Energiespeicher verwendet, die dann wiederum bei einer anderen chemischen Reaktion wieder Energie liefern können.

Gemischte Übungen
Die gerade gelernten Begriffe zum Energieumsatz bei chemischen Reaktionen, können nicht nur im Labor beobachtet werden. Auch im Alltag haben wir damit zu tun.