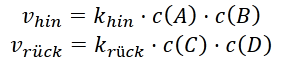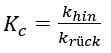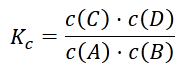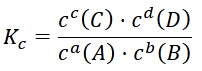Chemie-Lexikon/Das chemische Gleichgewicht
Gleichgewichtsreaktionen weisen bestimmte Merkmale auf, man kann sie auf bestimmte Weise beeinflussen, und sie erfordern bestimmte Voraussetzungen.
Voraussetzungen für Gleichgewichtsreaktionen
Voraussetzung dafür, dass eine Reaktion überhaupt einen Gleichgewichtszustand erreichen kann, ist, dass die Reaktion reversibel, also umkehrbar ist, und dass keines der Edukte oder Produkte aus dem Reaktionsgefäß entweichen kann (z. B. als Gas).
Ablauf einer Gleichgewichtsreaktion
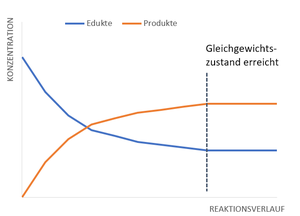
Die Edukte reagieren miteinander zu den Produkten. Je mehr von den Edukten vorhanden ist, desto schneller reagieren sie miteinander, weil die Reaktionsgeschwindigkeit von der Konzentration abhängt. Im Verlauf der Reaktion verringert sich also die Reaktionsgeschwindigkeit.
Sobald Produkte gebildet wurden, reagiert ein Teil der Produkte zurück zu den Edukten. Auch hier hängt die Reaktionsgeschwindigkeit von der Konzentration ab, die Reaktion läuft also erst langsam und dann immer schneller ab.
Irgendwann kommen wir an einen Punkt, an dem genauso viele Edukte zu Produkten reagieren wie umgekehrt.
Diesen Zustand nennt man Gleichgewichtszustand oder chemisches Gleichgewicht, und er ist durch bestimmte Merkmale gekennzeichnet.
Merkmale von Gleichgewichtsreaktionen
Hin- und Rückreaktion laufen gleich schnell ab, nach außen hin sieht es aber so aus, als würde nichts mehr passieren und als sei die Reaktion zum Stillstand gekommen. Weil die Reaktionen weiterhin ablaufen, spricht man von einem dynamischen Gleichgewicht.
Der Stoffumsatz ist nicht vollständig, das heißt die Edukte reagieren nicht komplett zu den Produkten, sondern es sind im Gleichgewichtszustand sowohl Edukte als auch Produkte vorhanden. Im Reaktionsgefäß liegen sie in einem bestimmten Verhältnis zueinander vor, das durch die Gleichgewichtskonstante bzw. das Massenwirkungsgesetz beschrieben wird und berechnet werden kann.
Wichtig: Dass die Konzentrationen der Edukte in einem bestimmten Verhältnis zu denen der Produkte stehen, heißt nicht, dass gleich viele Edukte wie Produkte vorhanden sind. Im Normalfall liegt das Gleichgewicht stark auf einer Seite, das heißt dass deutlich mehr Produkte als Edukte vorliegen (oder umgekehrt). Die Lage des chemischen Gleichgewichts kann man an der Gleichgewichtskonstanten erkennen.
Das Massenwirkungsgesetz
Das Massenwirkungsgesetz (MWG) beschreibt mathematisch das Verhältnis der beteiligten Stoffe zueinander, wenn eine chemische Reaktion sich im Gleichgewicht befindet.
Um das Massenwirkungsgesetz für eine Reaktion herzuleiten, benötigt man zuerst die Reaktionsgleichung.
Allgemeines Beispiel: A + B ⇌ C + D
Dann stellt man die Geschwindigkeitsgleichungen für die Hinreaktion und die Rückreaktion auf:
Im Gleichgewicht laufen die Hin- und die Rückreaktion gleich schnell ab, man kann also gleichsetzen:
oder
Die Gleichgewichtskonstante Kc ist definiert als
Durch Umstellen erhält man also folgenden Zusammenhang zwischen der Gleichgewichtskonstante und den Konzentrationen von Edukten und Produkten:
Diese Formel nennt man Massenwirkungsgesetz (MWG).
In diesem Fall reagieren jeweils gleiche Stoffmengen miteinander, z. B. jeweils 1 mol, und es entsteht jeweils dieselbe Stoffmenge. Normalerweise stehen jedoch noch Stöchiometriezahlen vor den chemischen Formeln der Stoffe, weil man von manchen Stoffen mehr benötigt oder weil mehr gebildet wird.
Eine allgemeinere Formulierung einer Reaktionsgleichung lautet also:
a A + b B ⇌ c C + d D
In diesem Fall werden aus den Stöchiometriezahlen im MWG Exponenten:
Diese Formel ist die allgemeine Formulierung des Massenwirkungsgesetzes (MWG). Mit ihrer Hilfe kann man
- die Gleichgewichtskonstante berechnen, wenn man die Konzentrationen der beteiligten Stoffe im Gleichgewichtszustand kennt,
- die Gleichgewichtskonzentrationen berechnen, wenn man die Gleichgewichtskonstante kennt.