Benutzer:Cloehner/Salze/Vom Atom zum Ion
Ihr habt die Halogene bereits als sehr reaktionsfreudige Elementfamilie kennengelernt. Mithilfe deines Wissens zum Bohr'schen Atommodell kannst du nun auch erklären, warum die Halogene so heftig reagieren.
Die Reaktion von Aluminium mit Chlor
Worin unterscheiden sich die Bestandteile des Aluminiumchlorids von den Atomen des Aluminiums und des Chlors?
Offensichtlich bildet sich aus Aluminium und Chlor in einer exothermen Reaktion ein neuer Stoff, das Aluminiumchlorid. Aluminiumchlorid ist ein Salz, das völlig andere Eigenschaften aufweist als die Edukte Aluminium und Chlor. Die veränderten Eigenschaften des Produktes lassen dich durch Veränderungen im Aufbau der Aluminium- und Chloratome, die unten abgebiledet sind, erklären.
Vorüberlegung: Die Reaktion von Natrium mit Chlor
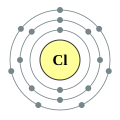
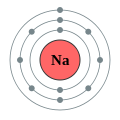
Auch Natrium und Chlor reagieren in einer exothermen Reaktion zu Nariumchlorid, welches wir unter dem Namen „Kochsalz” kennen. Wir betrachten noch einmal ein Natrium- und ein Chlor-Atom im Vergleich:
Bei exothermen chemischen Reaktionen entstehen häufig aus reaktiven, instabilen Teilchen neue Teilchen, die weniger reaktiv und deshalb stabiler sind. Wie könnten die stabileren „Verwandten” der Natrium- und der Chloratome aussehen?
Die Elementfamilie des Periodensystems, deren Elemente die stabilsten, reaktionsträgsten Atome haben, ist die Familie der Edelgase(). Diese Stoffe stehen in der 8.|achten() Hauptgruppe des Periodensystems. Das besondere an den Atomen dieser Hauptgruppe ist, dass sie alle eine voll besetzte|volle() Außenschale haben.
Damit das Natrium-Atom die besonders stabile Elektronenverteilung eines Edelgases erreicht, muss es ein Elektron abgeben. Dies kann jedoch nur passieren, wenn es einen Reaktionspartner gibt, der das abgegebene Elektron aufnimmt. Bei der Bildung von Natriumchlorid übernehmen diese Rolle die Chlor-Atome. Auch für die Atome des Chlors ist diese Elektronenübertragung vorteilhaft, da auch diese durch die Aufnahme eines Elektrons mit acht Valenzelektronen eine voll besetzte Außenschale bekommen. Dadurch, dass sich die Anzahl der Elektronen verändert während die Anzahl der Protonen gleich bleibt, entstehen bei dieser Reaktion geladene Teilchen, die in der Chemie als Ionen bezeichnet werden.
Fertigt in euren Unterlagen unter dem Merktext ein Reaktionsschema mit den Schalenmodellen der beteiligten Atome und Ionen an, in dem die beschriebenen Veränderungen im Aufbau der Teilchen deutlich werden.
Elektronenübertragungen bei der Bildung von Aluminiumchlorid
Übertragt das Prinzip der Elektronenübertragung auf die Reaktion von Aluminium und Chlor. Fertigt auch hierzu ein Reaktionsschnema wie in der letzten Aufgabe an.
Genauere Betrachtung der gebildeten Ionen
Dadurch, dass sich bei der Elektronenübertragung die Elektronenanzahl verändert, während die Anzahl der Protonen gleich bleibt, enstehen aus ungeladenen Atomen geladene Ionen.
Positiv geladene Ionen werden als Kationen bezeichnet.
Negativ geladene Ionen werden als Anionen bezeichnet.
Betrachtet die Ionen, die ihr bei den vorherigen Aufgaben gezeichnet habt. Notiert jeweils die Anzahl der Protonen und die der Elektronen. Wie ist die Ladung der einzelnen Ionen? Handelt es sich um Kationen oder Anionen?
Für Schnelle: Weitere Ionenverbindungen
Natriumchlorid und Aluminiumchlorid sind nur zwei Beispiele für die zahlreichen Ionenverbindungen.