Wir erforschen den Boden/Wir messen die Bodenversauerung elektrometrisch: Unterschied zwischen den Versionen
Main>Cereale Keine Bearbeitungszusammenfassung |
Main>Cereale Keine Bearbeitungszusammenfassung |
||
| Zeile 29: | Zeile 29: | ||
|- | |- | ||
| | | 1. Bestimmung frischer oder getrockneter Proben | ||
|- | |- | ||
| Zeile 44: | Zeile 44: | ||
|- | |- | ||
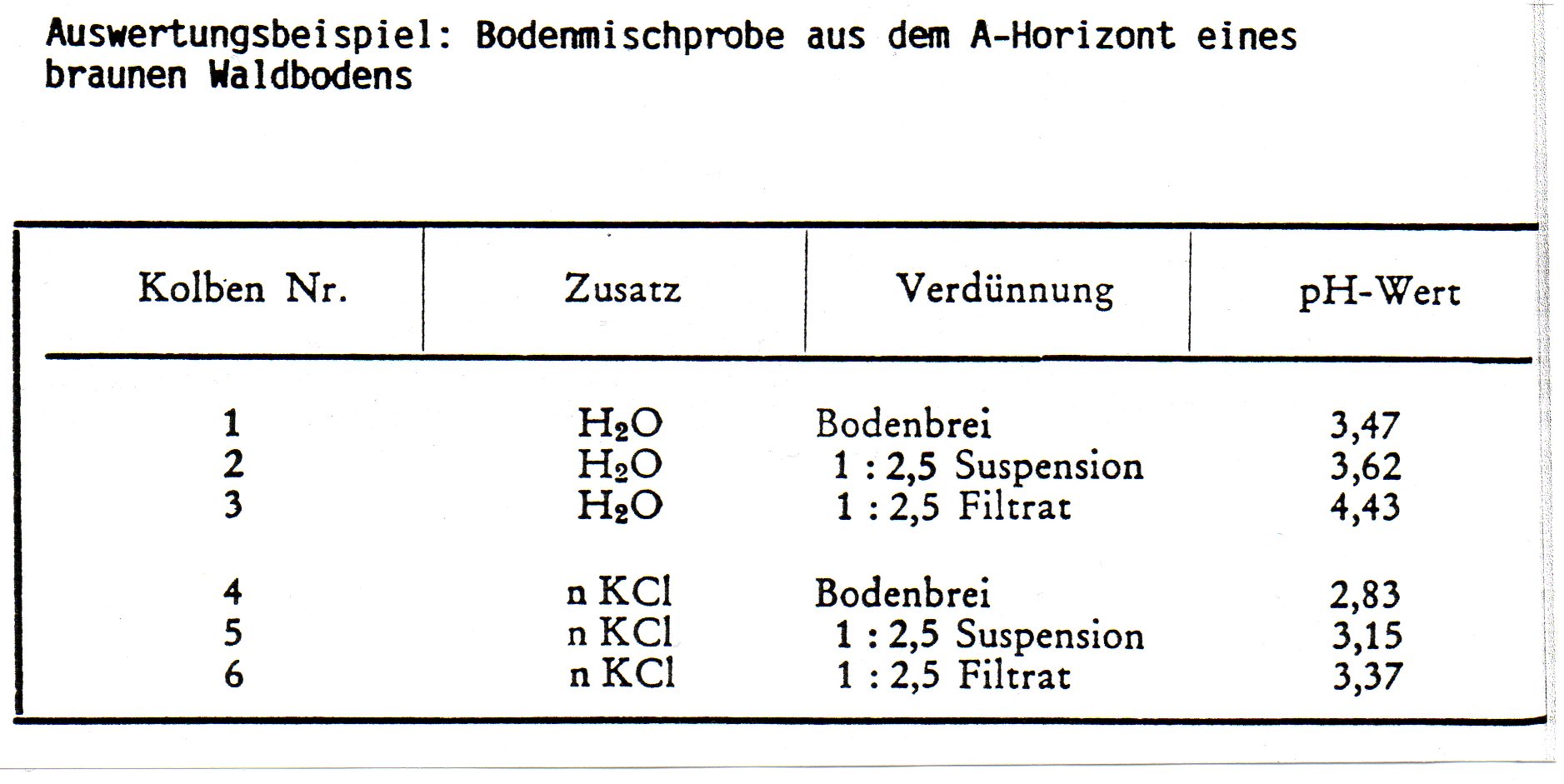
| Hinzu kommen Angaben über den Zeitpunkt und die Tiefe der Probennahme und darüber, ob sich die Werte auf Einzel- oder Mischproben beziehen. Für | | Hinzu kommen Angaben über den Zeitpunkt und die Tiefe der Probennahme und darüber, ob sich die Werte auf Einzel- oder Mischproben beziehen. Für pflanzenökologische Zwecke ist nur der in einer wässrigen Bodensuspension gemessene pH-Wert = pH (H20) brauchbar, da er den natürlichen Verhältnissen am besten entspricht. Von bodenkundlicher und agrikulturchemischer Seite wird dagegen die Probe in einer Salzlösung (meist n-KCl oder 0,1nKCl) aufgeschwemmt. Konventionell sind Boden und Flüssigkeit im Verhältnis 1 : 2,5 (bei humosen Böden 1 :10) zu mischen. | ||
| | ||
| Zeile 99: | Zeile 99: | ||
|- | |- | ||
| In sechs nummerierte | | In sechs nummerierte Gefäße werden je 10 g (oder 20 g) Boden eingewogen. In die Gefäße Nr. 2 + 3 werden 25 ml destilliertes Wasser und in die Gefäße Nr. 5 + 6 je 25 ml einmolare Kaliumchloridlßsung gegeben, so dass ein gut rührbarer Bodenbrei entsteht. Der Inhalt der Gefäße Nr. 2 + 3 + 5 + 6 wird gut umgerührt. Danach werden Lösungen Nr. 3 + 6 vom Bodensatz abfiltriert. Nach zehn Minuten erfolgt die pH-Messung im Bodenbrei, in der Bodenaufschwemmung und im Bodenfiltrat. Nach jeder Messung ist die Elektrode mit destilliertem Wasser bzw. Kaliumchloridlßsung gut abzuspülen. | ||
| | ||
| Zeile 110: | Zeile 110: | ||
|- | |- | ||
| Umgekehrt werden in neutralen | | Umgekehrt werden in neutralen Böden Hydroxid-Ionen freigesetzt. Mit steigendem Flüssigkeitszusatz erhöht sich in sauren Bßden der pH-Wert (in alkalischen wird er erniedrigt). Geringer Wasserzusatz (Brei) entspricht am besten den Standortverhältnissen: Die an den suspendierten Bodenteilchen adsorbierten Hydroxonium- bzw. Hydroxid-Ionen werden dann noch mit in die Reaktion einbezogen, während im Filtrat nur die tatsachlich abgespaltenen Hydroxonlum- bzw. Hydroxid-Ionen erfasst werden. | ||
|- | |- | ||
| Zeile 122: | Zeile 122: | ||
|- | |- | ||
| Oxonium (auch Oxidanium) ist die Bezeichnung für [http://de.wikipedia.org/wiki/Proton_(Chemie) protoniertes] [http://de.wikipedia.org/wiki/Wasser Wasser] (H3O+) und | | Oxonium (auch Oxidanium) ist die Bezeichnung für [http://de.wikipedia.org/wiki/Proton_(Chemie) protoniertes] [http://de.wikipedia.org/wiki/Wasser Wasser] (H3O+) und gehört nach [http://de.wikipedia.org/wiki/IUPAC IUPAC] zu den [http://de.wikipedia.org/wiki/Wasserstoff Wasserstoffionen]. Die Bezeichnungen Hydroxonium oder Hydronium sind veraltet und sollten nach den Empfehlungen der [http://de.wikipedia.org/wiki/Nomenklatur_(Chemie) chemischen Nomenklatur] nicht mehr verwendet werden, sind aber in der Literatur noch weit verbreitet. In der Literatur versteht man unter Oxoniumion auch häufig nur ein Sauerstoffkation mit drei Bindungen. In dieser Definition ist H3O+ ein Spezialfall. Im Englischen versteht man unter "oxonium ion" ausschließlich die allgemeiner gefasste Definition. | ||
| Zeile 135: | Zeile 135: | ||
|- | |- | ||
| | | gleiche Messdauer der Proben | ||
|- | |- | ||
| | |gleiche Verdünnung der Proben | ||
gleiches Verrühren der Proben | gleiches Verrühren der Proben | ||
| Zeile 145: | Zeile 145: | ||
|} | |} | ||
& | & | ||
Version vom 13. März 2009, 12:24 Uhr
Wir messen die Bodenversauerung elektrometrisch
|