Wir erforschen den Boden/Wir ermitteln den Calziumcarbonatgehalt durch Wägung: Unterschied zwischen den Versionen
Main>Cereale (Die Seite wurde neu angelegt: „__NOTOC__ {| class="prettytable" |<table border="1" width="100%"> |style="background-color:#EEE9BF ;"| <h3>Wir erforschen den Boden</h3> |[[Bild:Close-up of...“) |
Main>Cereale Keine Bearbeitungszusammenfassung |
||
| Zeile 13: | Zeile 13: | ||
<includeonly>[[Kategorie:Wir erforschen den Boden]]</includeonly> | <includeonly>[[Kategorie:Wir erforschen den Boden]]</includeonly> | ||
==Wir | ==Wir ermitteln den Calziumcarbonatgehalt durch Wägung== | ||
| | ||
| Zeile 20: | Zeile 20: | ||
|style="background-color:#EEE9BF ;" | | |style="background-color:#EEE9BF ;" | | ||
<h5 align="center">'''Informationen zum Thema'''</h5> | <h5 align="center">'''Informationen zum Thema'''</h5> | ||
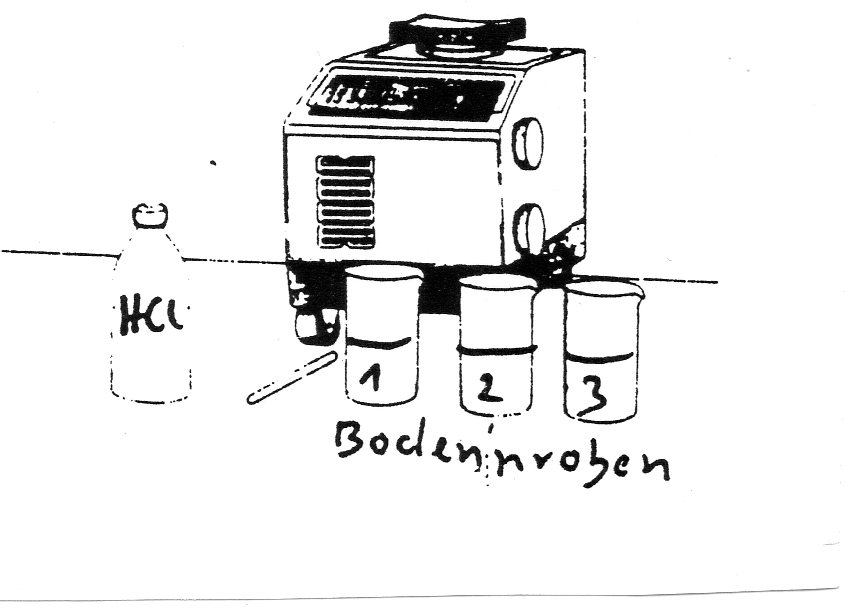
Durch Zugabe von Salzsäure auf Calziumcarbonat wird Kohlenstoffdioxid freigesetzt. Aus dem Gewichtsunterschied lässt sich auf den Kalkgehalt schließen. | |||
'''Untersuchungsmaterialie[[Image:Skizze7.jpg]]n''' | |||
genaue Waage | |||
1 n Salzsäure | |||
Bechergläser (50 ml) | |||
Saugpipette | |||
Bodenproben | |||
'''Versuchsablauf ''' | |||
- | |||
a) Wäge einzeln die 50 ml Bechergläser und beschrifte sie . | |||
b) Stelle ein Becherglas bekannten Gewichts auf die Waage und stelle die Anzeigenskala auf Null. | |||
c) Fülle 20 g Boden ein. | |||
d) Wäge 20 g Salzsäure ab. | |||
e) Beobachte, wie das Kohlenstoffdioxid entweicht. Wenn keine Blasen mehr aufsteigen, wäge erneut ab. | |||
f) Werte aus. Siehe Beispiel | |||
| |||
| '''Bodeneinwaage''' | |||
| colspan="3" | '''20,00 g''' | |||
| colspan="2" | | |||
|- | |||
| '''Salzsäurezugabe''' | |||
| colspan="3" | '''20,00 g''' | |||
| colspan="2" | | |||
|- | |||
| '''Summe''' | |||
| colspan="3" | '''40,00 g''' | |||
| colspan="2" | | |||
|- | |||
| colspan="2" | '''Nach der Reaktion (Kohlenstoffdioxid entweicht)''' | |||
| '''39,82 g''' | |||
| colspan="3" | | |||
|- | |||
| colspan="2" | '''entwichene Menge Kohlenstoffdioxid''' | |||
| '''0,18 g''' | |||
| colspan="2" | | |||
| | |||
|} | |||
| |||
<center> </center> | |||
'''Erfahrungen und Konsequenzen''' | |||
Der Versuch lässt sich nur mit einer genauen Waage durchführen. Die Schüler haben in der Regel Schwierigkeiten mit einer genauen Abwägung der Bodenproben. Waagen mit Digitalanzeige und automatischer Rückstellung erleichtern das Abwiegen. | |||
| |||
| |||
|} | |||
|- | |- | ||
Version vom 13. März 2009, 13:22 Uhr
Wir ermitteln den Calziumcarbonatgehalt durch Wägung
| |||||||||||||||||||||||||||||||||||