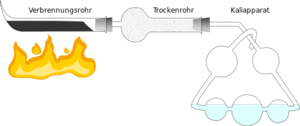Durchführung der Elementaranalyse: Unterschied zwischen den Versionen
(Durchführung und Berechnung eingefügt) |
(kat) Markierung: Quelltext-Bearbeitung 2017 |
||
| (Eine dazwischenliegende Version von einem anderen Benutzer wird nicht angezeigt) | |||
| Zeile 2: | Zeile 2: | ||
Grundsätzlich beruht die Methode darauf, dass man eine genau abgewogene Menge eines organischen Reinstoffs zu Kohlenstoffdioxid und Wasser reagieren lässt. Die Reaktionsprodukte werden aufgefangen, damit man ihre Masse bestimmen kann. Anhand der gemessenen Werte kann man das Verhältnis der Elemente berechnen, aus denen die untersuchte Verbindung besteht. | Grundsätzlich beruht die Methode darauf, dass man eine genau abgewogene Menge eines organischen Reinstoffs zu Kohlenstoffdioxid und Wasser reagieren lässt. Die Reaktionsprodukte werden aufgefangen, damit man ihre Masse bestimmen kann. Anhand der gemessenen Werte kann man das Verhältnis der Elemente berechnen, aus denen die untersuchte Verbindung besteht. | ||
[[Datei:Elementaranalyse nach Liebig.svg|alternativtext=Schematische Abbildung der Apparatur für die Elementaranalyse nach Liebig|mini|Elementaranalyse nach Liebig]] | |||
Für die quantitative Elementaranalyse benötigt man eine reine organische Substanz. Man muss also gegebenenfalls vorher durch verschiedene Reinigungsmethoden wie Destillation oder Chromatographie dafür sorgen, dass keine Verunreinigungen mehr enthalten sind. Von der gereinigten Substanz wiegt man eine ganz bestimmte Menge ein und gibt sie in einem Behälter ins '''Verbrennungsrohr'''. Ebenfalls im Verbrennungsrohr befindet sich Kupfer(II)-oxid, das als Oxidationsmittel dient. | Für die quantitative Elementaranalyse benötigt man eine reine organische Substanz. Man muss also gegebenenfalls vorher durch verschiedene Reinigungsmethoden wie Destillation oder Chromatographie dafür sorgen, dass keine Verunreinigungen mehr enthalten sind. Von der gereinigten Substanz wiegt man eine ganz bestimmte Menge ein und gibt sie in einem Behälter ins '''Verbrennungsrohr'''. Ebenfalls im Verbrennungsrohr befindet sich Kupfer(II)-oxid, das als Oxidationsmittel dient. | ||
[[Datei:Elementaranalyse | [[Datei:Liebigmuseum Elementaranalyse.jpg|alternativtext=Foto der Originalapparatur zur Elementaranalyse aus dem Liebig-Museum Gießen|mini|Der Fünfkugelapparat von Liebig im Liebig-Museum Gießen]] | ||
Nun erhitzt man das Kupfer(II)-oxid und die organische Substanz, was zu einer Redoxreaktion führt, bei der die Substanz zu Kohlenstoffdioxid und Wasser oxidiert wird und Kupfer(II)-oxid zu Kupfer reduziert wird. | Nun erhitzt man das Kupfer(II)-oxid und die organische Substanz, was zu einer Redoxreaktion führt, bei der die Substanz zu Kohlenstoffdioxid und Wasser oxidiert wird und Kupfer(II)-oxid zu Kupfer reduziert wird. | ||
Die entstandenen Gase (Kohlenstoffdioxid und Wasserdampf) werden durch die Apparatur geleitet. Das entstandene Wasser wird im '''Trockenrohr''' von Calciumoxid absorbiert. Das Kohlenstoffdioxid löst sich in der Kalilauge, die sich im '''Kaliapparat''' befindet. Sowohl vor als auch nach der Analyse bestimmt man die Masse des Trockenrohrs und des Kaliapparats, so dass man an der Gewichtszunahme sehen kann, wie viel Wasser und wie viel Kohlenstoffdioxid bei der Reaktion entstanden sind. | Die entstandenen Gase (Kohlenstoffdioxid und Wasserdampf) werden durch die Apparatur geleitet. Das entstandene Wasser wird im '''Trockenrohr''' von Calciumoxid absorbiert. Das Kohlenstoffdioxid löst sich in der Kalilauge, die sich im '''Kaliapparat''' befindet. Sowohl vor als auch nach der Analyse bestimmt man die Masse des Trockenrohrs und des Kaliapparats, so dass man an der Gewichtszunahme sehen kann, wie viel Wasser und wie viel Kohlenstoffdioxid bei der Reaktion entstanden sind. | ||
Wie man daraus die Verhältnisformel berechnet, wird hier erklärt: [[Berechnungen zur Elementaranalyse]] | |||
[[Kategorie:Chemie]] | |||
Aktuelle Version vom 23. April 2022, 13:08 Uhr
Ursprünglich erfunden wurde diese Methode, die generell für die Bestimmung von Elementverhältnissen in organischen Verbindungen geeignet ist, von Antoine de Lavoisier, erheblich verbessert wurde sie später von Justus von Liebig, nach dem sie häufig benannt wird.
Grundsätzlich beruht die Methode darauf, dass man eine genau abgewogene Menge eines organischen Reinstoffs zu Kohlenstoffdioxid und Wasser reagieren lässt. Die Reaktionsprodukte werden aufgefangen, damit man ihre Masse bestimmen kann. Anhand der gemessenen Werte kann man das Verhältnis der Elemente berechnen, aus denen die untersuchte Verbindung besteht.
Für die quantitative Elementaranalyse benötigt man eine reine organische Substanz. Man muss also gegebenenfalls vorher durch verschiedene Reinigungsmethoden wie Destillation oder Chromatographie dafür sorgen, dass keine Verunreinigungen mehr enthalten sind. Von der gereinigten Substanz wiegt man eine ganz bestimmte Menge ein und gibt sie in einem Behälter ins Verbrennungsrohr. Ebenfalls im Verbrennungsrohr befindet sich Kupfer(II)-oxid, das als Oxidationsmittel dient.
Nun erhitzt man das Kupfer(II)-oxid und die organische Substanz, was zu einer Redoxreaktion führt, bei der die Substanz zu Kohlenstoffdioxid und Wasser oxidiert wird und Kupfer(II)-oxid zu Kupfer reduziert wird.
Die entstandenen Gase (Kohlenstoffdioxid und Wasserdampf) werden durch die Apparatur geleitet. Das entstandene Wasser wird im Trockenrohr von Calciumoxid absorbiert. Das Kohlenstoffdioxid löst sich in der Kalilauge, die sich im Kaliapparat befindet. Sowohl vor als auch nach der Analyse bestimmt man die Masse des Trockenrohrs und des Kaliapparats, so dass man an der Gewichtszunahme sehen kann, wie viel Wasser und wie viel Kohlenstoffdioxid bei der Reaktion entstanden sind.
Wie man daraus die Verhältnisformel berechnet, wird hier erklärt: Berechnungen zur Elementaranalyse