Wir erforschen den Boden/Wir messen die Bodenversauerung elektrometrisch: Unterschied zwischen den Versionen
Aus ZUM-Unterrichten
Main>Cereale Keine Bearbeitungszusammenfassung |
Main>Cereale Keine Bearbeitungszusammenfassung |
||
| Zeile 99: | Zeile 99: | ||
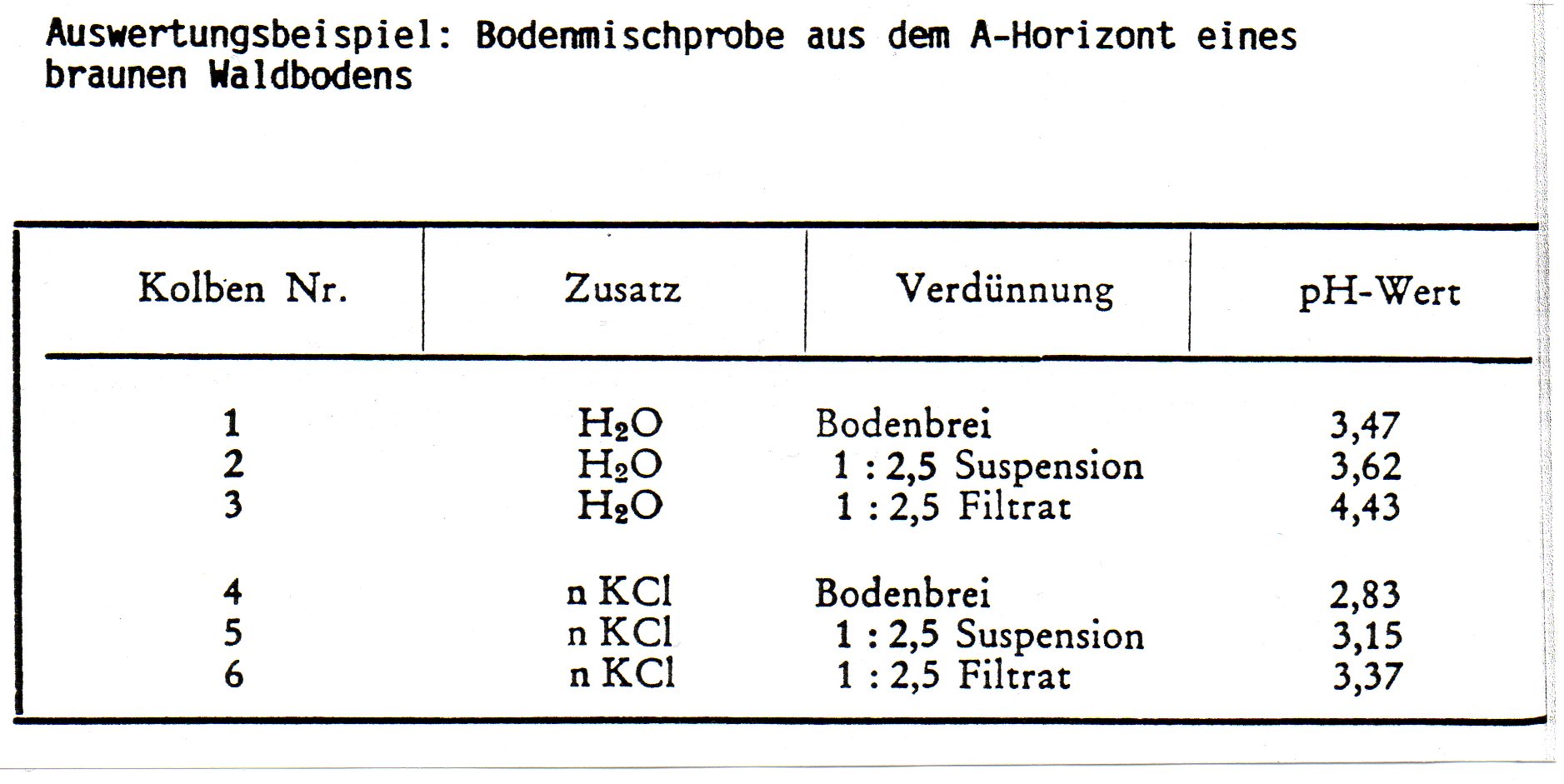
| In sechs nummerierte Gefäße werden je 10 g (oder 20 g) Boden eingewogen. In die Gefäße Nr. 2 + 3 werden 25 ml destilliertes Wasser und in die Gefäße Nr. 5 + 6 je 25 ml einmolare Kaliumchloridlßsung gegeben, so dass ein gut rührbarer Bodenbrei entsteht. Der Inhalt der Gefäße Nr. 2 + 3 + 5 + 6 wird gut umgerührt. Danach werden Lösungen Nr. 3 + 6 vom Bodensatz abfiltriert. Nach zehn Minuten erfolgt die pH-Messung im Bodenbrei, in der Bodenaufschwemmung und im Bodenfiltrat. Nach jeder Messung ist die Elektrode mit destilliertem Wasser bzw. Kaliumchloridlßsung gut abzuspülen. | | In sechs nummerierte Gefäße werden je 10 g (oder 20 g) Boden eingewogen. In die Gefäße Nr. 2 + 3 werden 25 ml destilliertes Wasser und in die Gefäße Nr. 5 + 6 je 25 ml einmolare Kaliumchloridlßsung gegeben, so dass ein gut rührbarer Bodenbrei entsteht. Der Inhalt der Gefäße Nr. 2 + 3 + 5 + 6 wird gut umgerührt. Danach werden Lösungen Nr. 3 + 6 vom Bodensatz abfiltriert. Nach zehn Minuten erfolgt die pH-Messung im Bodenbrei, in der Bodenaufschwemmung und im Bodenfiltrat. Nach jeder Messung ist die Elektrode mit destilliertem Wasser bzw. Kaliumchloridlßsung gut abzuspülen. | ||
|} | |||
{| class="prettytable" | |||
|<table border="1" width="100%"> | |||
|style="background-color:#EEE9BF ;" | | |||
<h5 align="center">'''Auswertungsbeispiel'''</h5> | |||
|- | |- | ||
| pH (KCl) liegt in sauren Bßden tiefer, in basischen hßher als der pH (H20). Die Ursache ist darin zu suchen, dass die mit der Salzlßsung zugefügten Kationen gegen einen Teil der Hydroxionium-Ionen aus dem Ionenschwarm der Bodenkolloide ausgetauscht werden. Die somit freigesetzten Hydroxonium-Ionen erniedrigen damit den pH-Wert. | | pH (KCl) liegt in sauren Bßden tiefer, in basischen hßher als der pH (H20). Die Ursache ist darin zu suchen, dass die mit der Salzlßsung zugefügten Kationen gegen einen Teil der Hydroxionium-Ionen aus dem Ionenschwarm der Bodenkolloide ausgetauscht werden. Die somit freigesetzten Hydroxonium-Ionen erniedrigen damit den pH-Wert. | ||
| Zeile 110: | Zeile 113: | ||
| Umgekehrt werden in neutralen Böden Hydroxid-Ionen freigesetzt. Mit steigendem Flüssigkeitszusatz erhöht sich in sauren Bßden der pH-Wert (in alkalischen wird er erniedrigt). Geringer Wasserzusatz (Brei) entspricht am besten den Standortverhältnissen: Die an den suspendierten Bodenteilchen adsorbierten Hydroxonium- bzw. Hydroxid-Ionen werden dann noch mit in die Reaktion einbezogen, während im Filtrat nur die tatsachlich abgespaltenen Hydroxonlum- bzw. Hydroxid-Ionen erfasst werden. | | Umgekehrt werden in neutralen Böden Hydroxid-Ionen freigesetzt. Mit steigendem Flüssigkeitszusatz erhöht sich in sauren Bßden der pH-Wert (in alkalischen wird er erniedrigt). Geringer Wasserzusatz (Brei) entspricht am besten den Standortverhältnissen: Die an den suspendierten Bodenteilchen adsorbierten Hydroxonium- bzw. Hydroxid-Ionen werden dann noch mit in die Reaktion einbezogen, während im Filtrat nur die tatsachlich abgespaltenen Hydroxonlum- bzw. Hydroxid-Ionen erfasst werden. | ||
|- | |} | ||
{| class="prettytable" | |||
|<table border="1" width="100%"> | |||
|style="background-color:#EEE9BF ;" | | |||
<h5 align="center">'''Hinweis'''</h5> | |||
|- | |- | ||
| Zeile 122: | Zeile 131: | ||
| Oxonium (auch Oxidanium) ist die Bezeichnung für [http://de.wikipedia.org/wiki/Proton_(Chemie) protoniertes] [http://de.wikipedia.org/wiki/Wasser Wasser] (H3O+) und gehört nach [http://de.wikipedia.org/wiki/IUPAC IUPAC] zu den [http://de.wikipedia.org/wiki/Wasserstoff Wasserstoffionen]. Die Bezeichnungen Hydroxonium oder Hydronium sind veraltet und sollten nach den Empfehlungen der [http://de.wikipedia.org/wiki/Nomenklatur_(Chemie) chemischen Nomenklatur] nicht mehr verwendet werden, sind aber in der Literatur noch weit verbreitet. In der Literatur versteht man unter Oxoniumion auch häufig nur ein Sauerstoffkation mit drei Bindungen. In dieser Definition ist H3O+ ein Spezialfall. Im Englischen versteht man unter "oxonium ion" ausschließlich die allgemeiner gefasste Definition. | | Oxonium (auch Oxidanium) ist die Bezeichnung für [http://de.wikipedia.org/wiki/Proton_(Chemie) protoniertes] [http://de.wikipedia.org/wiki/Wasser Wasser] (H3O+) und gehört nach [http://de.wikipedia.org/wiki/IUPAC IUPAC] zu den [http://de.wikipedia.org/wiki/Wasserstoff Wasserstoffionen]. Die Bezeichnungen Hydroxonium oder Hydronium sind veraltet und sollten nach den Empfehlungen der [http://de.wikipedia.org/wiki/Nomenklatur_(Chemie) chemischen Nomenklatur] nicht mehr verwendet werden, sind aber in der Literatur noch weit verbreitet. In der Literatur versteht man unter Oxoniumion auch häufig nur ein Sauerstoffkation mit drei Bindungen. In dieser Definition ist H3O+ ein Spezialfall. Im Englischen versteht man unter "oxonium ion" ausschließlich die allgemeiner gefasste Definition. | ||
|} | |} | ||
[[Image:Tabelle3.jpg]] | [[Image:Tabelle3.jpg]] | ||
{| class="prettytable" | |||
|<table border="1" width="100%"> | |||
|style="background-color:#EEE9BF ;" | | |||
<h5 align="center">'''Erfahrungen und Konsequenzen'''</h5> | |||
|- | |- | ||
| Der Versuch ist als Gruppenarbeit geeignet. Für alle Messungen sind die Versuchsbedingungen mßglichst einheitlich zu gestalten: | | Der Versuch ist als Gruppenarbeit geeignet. Für alle Messungen sind die Versuchsbedingungen mßglichst einheitlich zu gestalten: | ||
Version vom 13. März 2009, 12:34 Uhr
Wir messen die Bodenversauerung elektrometrisch
|