Stoßtheorie: Unterschied zwischen den Versionen
(Bilder und Text ergänzt) Markierung: Quelltext-Bearbeitung 2017 |
(kst) Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 35: | Zeile 35: | ||
Dies lässt sich anhand der Konzentrationsabhängigkeit erklären. Der Teig geht auf, weil die Enzyme in Hefe Zucker und Stärke unter anderem zu Kohlenstoffdioxid umsetzen. Das entstehende Gas macht den Teig locker und lässt ihn aufgehen. Je mehr Hefe im Teig ist, desto mehr Enzyme sind vorhanden, die für das Aufgehen des Teiges sorgen. | Dies lässt sich anhand der Konzentrationsabhängigkeit erklären. Der Teig geht auf, weil die Enzyme in Hefe Zucker und Stärke unter anderem zu Kohlenstoffdioxid umsetzen. Das entstehende Gas macht den Teig locker und lässt ihn aufgehen. Je mehr Hefe im Teig ist, desto mehr Enzyme sind vorhanden, die für das Aufgehen des Teiges sorgen. | ||
[[Kategorie:Chemie]] | |||
Version vom 23. April 2022, 13:24 Uhr
Die Stoßtheorie (auch Kollisionstheorie genannt) ist ein Modell auf der Teilchenebene, das erklärt, wie es zu chemischen Reaktionen kommt und welche Voraussetzungen gegeben sein müssen, damit eine Reaktion überhaupt abläuft.
Man geht davon aus, dass die Teilchen der Edukte sich ungeordnet bewegen. Je höher die Temperatur ist, desto stärker bewegen sich die Teilchen. Aufgrund der Teilchenbewegung stoßen diese zusammen, sie kollidieren miteinander. Diese Zusammenstöße können dazu führen, dass die Teilchen miteinander reagieren, wenn bestimmte Voraussetzungen erfüllt sind.
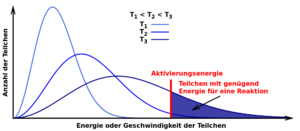
Zum einen müssen die Teilchen eine bestimmte Mindestenergie aufweisen, sie müssen sich also schnell genug bewegen. Diese Mindestenergie entspricht der Aktivierungsenergie.
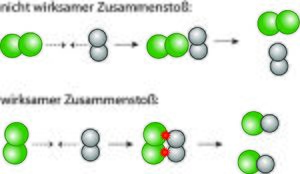
Zum anderen müssen die Teilchen in der richtigen Ausrichtung zueinander kollidieren. Nur wenn diese beiden Bedingungen (Mindestenergie und räumliche Ausrichtung) erfüllt sind, kommt es zu einem wirksamen Zusammenstoß und damit zur Reaktion der Teilchen miteinander.
Je häufiger es zu wirksamen Zusammenstößen kommt, desto schneller reagieren die Ausgangsstoffe miteinander.
Beeinflussung der Reaktionsgeschwindigkeit
Natürlich gibt es Faktoren, die die Anzahl der wirksamen Zusammenstöße und damit die Reaktionsgeschwindigkeit beeinflussen. Einer davon ist die Temperatur. Je wärmer es ist, desto schneller bewegen sich die Teilchen und desto mehr Teilchen haben die nötige Mindestenergie, die eine der Voraussetzungen für einen wirksamen Zusammenstoß ist (s. Diagramm oben).
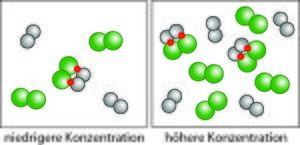
Außerdem beeinflusst die Konzentration der Reaktionspartner die Reaktionsgeschwindigkeit. Je mehr Teilchen vorhanden sind, desto öfter treffen sie so aufeinander, dass es zur Reaktion kommt.
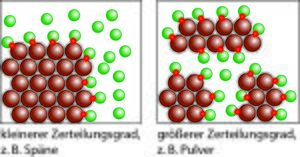
Als Variante der Konzentration kann man den Zerteilungsgrad von Feststoffen betrachten. Zerteilt man größere Stücke in kleinere, so erhält man mehr Stückchen mit einer insgesamt größeren Oberfläche. Da Feststoffe nur an ihrer Oberfläche reagieren können, da nur hier die Atome für den Reaktionspartner zugänglich sind, führt eine Vergrößerung der Oberfläche zu mehr möglichen Zusammenstößen und damit zu einer Erhöhung der Reaktionsgeschwindigkeit. Ein Feststoff in Pulverform reagiert daher schneller, als wenn er in größeren Stücken vorliegt.
Beispiele aus dem Alltag
Mithilfe der Stoßtheorie kann man viele alltägliche Phänomene erklären, z. B.
Wieso verderben Lebensmittel nicht so schnell, wenn sie gekühlt werden?
Wenn Lebensmittel verderben, laufen dabei chemische Reaktionen ab, die aus den Inhaltsstoffen der Lebensmittel neue, für uns giftige Stoffe entstehen lassen. Je niedriger die Temperatur, desto weniger bewegen sich die Teilchen, desto weniger Zusammenstöße gibt es, desto weniger Teilchen reagieren. Hinzu kommt, dass die Vorgänge, die zum Verderben von Lebensmitteln führen, in der Regel von Bakterien bewirkt werden, deren Enzyme die ablaufenden Reaktionen katalysieren. Die Enzyme funktionieren bei kühleren Temperaturen nicht so gut wie bei Raumtemperatur.
Wieso soll man die Entkalkerlösung beim Entkalken erhitzen?
Zum Entkalken verwendet man Säuren, die mit dem Kalk reagieren, so dass Kohlenstoffdioxid entsteht. Beim Erhitzen erhöht sich die Energie der Säureteilchen und sie bewegen sich schneller. Die Anzahl der wirksamen Zusammenstöße und damit die Reaktionsgeschwindigkeit wird erhöht. Außerdem löst sich Kohlenstoffdioxid in heißem Wasser schlechter als in kaltem Wasser, daher entweicht es rascher aus der Entkalkerlösung. Hinweis: Entkalker mit Citronensäure bitte nicht erhitzen, weil dann schwerlösliches Calciumcitrat ausfällt!
Wieso brennen Sägespäne besser als ein Holzklotz?
Hier macht der Zerteilungsgrad bzw. die viel größere Oberfläche von Sägespänen den entscheidenden Unterschied. Sauerstoffmoleküle können daher besser mit den Sägespänen reagieren. Will man ein Feuer entzünden, fängt man aus diesem Grund mit leicht brennbaren Materialien an und legt nach und nach größere Holzstücke dazu. Ist es durch die Verbrennungswärme erst einmal heiß genug, fängt dann auch der Holzklotz an zu brennen.
Wieso geht Hefeteig schneller auf, wenn man mehr Hefe hinzufügt?
Dies lässt sich anhand der Konzentrationsabhängigkeit erklären. Der Teig geht auf, weil die Enzyme in Hefe Zucker und Stärke unter anderem zu Kohlenstoffdioxid umsetzen. Das entstehende Gas macht den Teig locker und lässt ihn aufgehen. Je mehr Hefe im Teig ist, desto mehr Enzyme sind vorhanden, die für das Aufgehen des Teiges sorgen.