Oberstufen-Chemiebuch Kontextorientiert/Zucker chemisch betrachtet
Allgemein kann man sagen dass alle Zucker-Arten, neben Eiweiß und Fett der dritte wichtige Nahrungsbestandteil im Tier- und Pflanzenreich darstellt.
Unter Zucker bzw. Kohlenhydraten verstand man lange Verbindungen, die neben Kohlenstoff noch Wasserstoff und Sauerstoff im Verhältnis 2:1 (also wie beim Wasser) enthält und die Summenformeln CnH2nOn hat. Inzwischen man allerdings andere natürliche Zuckersorten gefunden, bei denen diese Regeln nicht mehr gelten. Außerdem gibt es auch Verbindunge mit Schwefel, die man zu den Kohlenhydraten zählt.
Eine andere/eindeutigere Definition für Kohlenhydrate wäre Oxidationsprodukte mehrwertiger Alkohole.
Grob unterteilt man alle Kohlenhydrate in drei Gruppen, denn kleinere Kohlenhydrate können sich durch eine Kondensationsreaktion verbinden und so größere Moleküle bilden:
- Monosaccharide (Einfache Zucker) ... meist Pentosen C5H10O5 (z.B. die Ribose) und Hexosen C6H12O6 (wie die Glucose und Fructose).
- Oligosaccharide ... hier sind 2 bis 6 Monsaccharide mit einander verbunden. Speziell zu den Disacchariden sind gehören die Saccharose (Rohrzucker, Rübenzucker), Maltose (Malzzucker) und Lactose (Milchzucker).
- Polysaccharide ... langkettige Polymere, im Prinzip die Fortführung der Verbindung bei den Oligosacchariden, allerdings ist das Verhalten dieser Polysaccharide nicht wirklich mit denen der Monosaccharide und Oligosaccharide vergleichbar. Wichtige Beispiele sind die Stärke, Cellulose und Glykogen (verzweigtes Poylsaccharid, das kurz- bis mittelfristigen Speicherung und Bereitstellung des Energieträgers Glucose dient).
Der systematische Name eines Monosaccharids enthält immer die Endung "-ose". Bei Oligo- und Polysaccharide gibt es teilweise Trivialnamen, ohne diese Endung.
Monosaccharide
Wie schon erwähnt sind Kohlenhydrate Oxidationsprodukte mehrwertiger Alkohole. Je nachdem ob eine primäre oder sekundäre Alkohol-Gruppe oxidiert wird erhält man entweder eine ...
- Aldose ... wenn eine primäre Gruppe oxidiert wurde, enthält man eine Aldehyd-Gruppe.
- Ketose ... wenn eine sekundäre Gruppe oxidiert wurde, enthält man eine Keto-Gruppe.
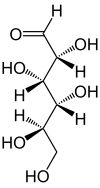
Im folgenden Bild ist links eine Aldose, rechts eine Ketose

Das einfachste mögliche Kohlenhydrat wäre ein oxidiertes Glykol, was dann eine Aldobiose ergäbe oder Glykolaldehyd.

Optische Aktivität
Eine Besonderheit, die bei fast allen Kohlenhydraten auftritt, ist die sogenannte optische Aktivität.

Licht ist ja eine elektromagnetische Welle. Normalerweise enthält Licht Wellen, die in allen möglichen Richtungen/Ebenen schwingen(2), also quasi durcheinander. Ein Polarimeter(3) sorgt dafür, dass nur Licht durchkommt, dass in einer bestimmten Ebene(4) schwingt. Einige Substanzen(5) haben eine Auswirkung auf die Schwingungsebene und zwar in dem Sinne, dass die Schwingungsebene verdreht wird(6). Mit Hilfe von einem zweiten Polarimeter(7) kann man untersuchen, wie weit sich die Schwingungsebene verdreht hat.
Optisch aktive Substanzen haben natürlich auch auf "normales", also nicht polarisiertes Licht diese Auswirkung, nur wird es erst mit Hilfe von zwei Polarisationsfiltern sichtbar.
Dieser Effekt der optischen Aktivität tritt nicht nur bei Zuckern auf, sondern bei vielen anderen Stoffen. Die Besonderheit ist, dass immer mindestens ein Atom vorkommen muss, das vier verschiedene Substituenten hat. Das ist hier im folgenden Molekül der Fall, wo das zentrale Kohlenstoff-Atom als Substitutenten eine Wasser-Atom, eine Methyl-Gruppe, ein Chlor- und eine Brom-Atom besitzt. Üblicherweise hebt man ein solches Kohlenstoff-Atom mit einem Sternchen hervor.

Man bezeichnet dieses Kohlenstoff-Atom asymmetrisch oder als Stereozentrum. Solche Verbindungen bezeichnet man auch als chiral.
Wenn das der Fall ist, kann es aufgrund der räumlichen Anordnung der vier Substituenten passieren, dass man Moleküle zusammenbaut, bei denen zwar die Atome identisch zusammengesetzt sind, die aber nicht zur Deckung gebracht werden können. Diese Moleküle verhalten sich dann wie Bild und Spiegelbild zueinander, wie es auch bei unseren beiden Händen der Fall ist.

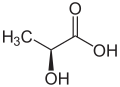
Die rechtsdrehende Milchsäure
Für eine gewisse Zeit war es im Lebensmittelhandel, speziell in den Kühlregalen üblichen die Milchprodukte mit Beschriftungen zu versehen wie diese:
Mit dem Vorwissen oder Optische Aktivität ist sicher klar, dass es genau darum geht. Eines der einfachsten Moleküle, dass optisch aktiv ist, ist nämlich die Milchsäure.
Was die Benennung (also L bzw. D) betrifft, so schauen wir uns das noch später an. Die Richtung, in der die Schwingungsebene des polarisierten Lichtes verdreht wird, wird mit (+) für rechtsdrehend und (-) für linksdrehend bezeichnet. Der Drehwinkel ist übrigens eine Stoffeigenschaft. Der Winkel ist dabei abhängig von der Temperatur, von der Konzentration und dem Lösungsmittel. Der sogenannte spezifische Drehwinkel für D-Milchsäure ist . Dabei steht das hochgestellte 20 für die Temperatur, hintendran steht das Lösungmittel, dort wird oft auch die Konzentration in g pro 100 ml Lösungsmittel angegeben, das D steht für gelbes Natriumlicht (die Natrium-D-Linie). Für L-Milchsäure ist
Die Drehwinkel von zwei Enantiomeren, die zwei zueinander spiegelsymmetrischen Moleküle, sind vom Wert immer identisch, aber mit gegensätzlichem Vorzeichen.
L-(+)-Milchsäure kommt in Schweiß, Blut, Speichel, im Muskelserum, in der Niere und Galle vor. Das Racemat, eine 1:1-Mischung aus D- und L-Milchsäure, findet sich z. B. in Sauermilch- und Molkeprodukten, Tomatensaft und Bier. Bei allen Produkten, die per Milchsäuregärung haltbar gemacht werden, ist der Anteil der beiden Enantiomere abhängig vom verwendeten Bakterienstamm und den Reaktionsbedingungen.
Früher stand linksdrehende Milchsäure im Verdacht, vom Körper schlechter verwertet zu werden. Doch dies wurde inzwischen widerlegt. Der menschliche Körper produziert selbst beide Milchsäurearten und kann beide verwerten. Allerdings sollten Säuglinge und Kleinkinder in den ersten zwölf Monaten sowie Menschen, bei denen ein großer Teil des Dünndarms entfernt werden musste, mit linksdrehender Milchsäure vorsichtig sein. Sie können den Stoff wohl nicht gut abbauen, was zu einer Übersäuerung des Blutes führen kann. Für gesunde Kinder über zwölf Monate sowie Jugendliche und Erwachsene ist der Verzehr jedoch gesundheitlich unproblematisch.
Sonderfälle
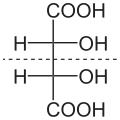
Es gibt aber auch Sonderfälle, bei denen man trotz asymmetrisch besetzten C-Atomen keine optische Aktivität haben. Die Weinsäure etwa gibt es in drei Varianten. Zwei Varianten, die optisch aktiv sind und eine dritte, bei denen die Substituenten so angeordnet sind, dass das Molekül in sich symmetrische ist. Diese sogenannten Meso-Weinsäure ist optisch inaktiv.
Die Fischer-Projektion
Wie bei anderen größeren Molekülen, haben wir auch bei Kohlenhydraten ja die Möglichkeit, dass man Atome unterschiedlich anordnen kann. Dies auf dem Papier darzustellen ist dann noch einfach, wenn die Atome ganz anders zusammen gesetzt sind. Man hat dann sogenannte Konstitutionsisomere. Bei den Kohlenhydrate kommt aber noch dazu, dass die Zusammensetzung identisch, es aber unterschiedliche räumliche Anordnungen gibt, die zur optischen Aktivität führen.
Emil Fischer, der neben Killani und Tollens die Struktur der Kohlenhydrate geklärt hat, haben wir eine Möglichkeit zu verdanken, dies eigentlich recht einfach zu notieren. Dabei muss man die Kohlenstoff-Kette senkrecht von oben nach unten zeichnen, wobei das am stärksten oxidierte Atom oben steht. Statt den Kohlenstoff-Atomen zeichnet man dann einfach ein "Kreuz" bzw. eine Art "Kreuz-Skelett" bei mehr als vier C-Atomen.

Beispiele zu der Triose Glycerinaldehyd:

Und hier Tetrosen:

Weiterhin gilt:
- Horizontale (waagerechte) Linien zeigen auf den Betrachter zu.
- Vertikale (senkrechte) Linien laufen vom Betrachter weg.
Im Modell führt das zu einer gekrümmten Kette, wenn man diese Moleküle mit einem Molekülbaukasten nachbaut.
Geht man von dieser Art der Darstellung aus, ergeben sich verschiedene Anordnungen für die mittleren Kohlenstoff-Atome. Diese wiederum bestimmen den Namen der Verbindung.

(1) D-(+)-Glycerinaldehyd;
(2a) D-(−)-Erythrose; (2b) D-(−)-Threose;
(3a) D-(−)-Ribose; (3b) D-(−)-Arabinose; (3c) D-(+)-Xylose; (3d) D-(−)-Lyxose;
(4a) D-(+)-Allose; (4b) D-(+)-Altrose; (4c) D-(+)-Glucose; (4d) D-(+)-Mannose; (4e) D-(−)-Gulose; (4f) D-(−)-Idose; (4g) D-(+)-Galactose; (4h) D-(+)-Talose
Hier haben wir wieder, wie bei der Milchsäure und den anderen Beispielen, den Buchstaben "D", der dem Namen vorangestellt wird. Entsprechend spiegelsymmetrisch sind dann die entsprechenden "L"-Varianten.
Ob eine Variante L oder D ist hängt davon ab, auf welcher Seite der Substituent -OH in der Fischer-Projektion am untersten asymmetrischen C-Atom steht. Die beiden äußeren C-Atome sind übrigens immer asymmetrisch, da sie zwei H-Atome besitzen.
Im Bild rechts hat man ein Glucose-Molekül und die OH-Gruppe am zweituntersten C-Atom steht auf der linken Seite. Daher ist es L-Glucose.
Die Buchstaben leiten sich folgendermaßen her:
- L von lateinisch leavus = links
- D von lateinisch dexter = rechts ... im Französischen auch "a droit"
Von dem langen Namen für Saccharose können wir die ersten Abschnitte nun klären:
D-Fructo kommt von D-Fructose und D-gluco von D-Glucose.
Wir haben hier also ein Disaccharrid, das aus D-Fructose und D-Glucose zusammengesetzt wurde.Ringbildung
Um die weiteren Namensbestandteile von Saccharose zu klären, konzentrieren wir uns auf die D-Glucose.
Nach der Fischerprojekt ist ein Glucose-Molekül ja eine lange Kette. Tatsächlich aber liegt Glucose immer ringförmig vor. Dieser Ring kommt dadurch zustande, dass das Aldehyd-Gruppe mit einer OH-Gruppe reagiert. Das C-Atom der Aldehyd-Gruppe geht eine Bindung zum O, der OH-Gruppe ein. Dies wird Umlagerung eines H-Atoms möglich, von der OH-Gruppe zum O der Aldehyd-Gruppe.

Chemisch betrachtet reagieren hier eine Alkohol-Gruppe mit einer Carbonyl-Gruppe C=O. Dabei enstehen sogenannte Halbacetale. Das H+ über dem Doppelpfeil deutet an, dass die Reaktion von Säure katalysiert wird. Außerdem ist die Reaktion eine Gleichgewichtsreaktion und kann in beide Richtungen stattfinden.

Furanose und Pyranose
Je nachdem, welches der OH-Gruppen sich an dieser Ringbildung beteiligt, kann es zu verschiedengroßen Ringen kommen. Üblich sind eigentlich nur 5er-Ringe und 6er-Ringe, wobei man beachten muss, dass immer ein Sauerstoff-Atom in dem Ring enthalten ist. Grund dafür ist, dass diese Ringe am günstigsten sind, was die Winkel in der Kohlenstoffkette/-bzw. dem Kohlenstoffring betrifft. Bei einem 4er-Ring wäre der Winkel etwa 90° und dass zu weit vom typischen Tetraeder-Winkel von etwa 109° entfernt. Bei einem 5er hat man dagegen 108°, wenn die fünf C-Atome eben angeordnet sind. Beim 6er-Ring ordnen sich die C-Atome in verschiedenen verdrehten Varianten an, die wir später nach einmal kurz ansprechen.
Der Name für die jeweilige Variante des Zuckers leiten sich von den Namen von ringförmigen Verbindungen ab, die Suaerstoff-Atom im Ring haben, nämlich vom Furan und vom Pyran.
| Furan, Tetrahydrofuran und Furanose | |||
| Name | Furan | Tetrahydrofuran | α-D-Altrofuranose |
| Strukturformel |  |
 |

|
| Bemerkung | Furan-Ring (blau) | Tetrahydrofuran-Ring (blau) | Tetrahydrofuran-Ring blau markiert |
| Tetrahydropyrane (Pyrane) | |||
| Name | Pyran | Tetrahydropyran | α-D-(+)-Glucopyranose |
| Strukturformel |  |
 |

|
| Bemerkung | - | Tetrahydropyran-Ring (blau) | Tetrahydropyran-Ring blau markiert |
- Fructofuranosyl bedeutet, dass die Fructose einen 5er-Ring bildet
- Glucopyranosid bedeutet, dass die Glucose einen 6er-Ring bildet
Haworth-Projektion
Bei der Ringbildung ist es ja so, dass bei der Aldehyd- bzw. Keto-Gruppe die Doppelbindung zum Sauerstoff geöffnet wird. Dadurch entsteht an dem C-Atom der ehemaligen Aldehyd- bzw. Keto-Gruppe ein weiteres asymmetrischen Kohlenstoff-Atom und somit kann es wiederum zwei verschiedene Varianten geben. Diese werden mit den griechischen Buchstaben α- bzw. β bezeichnet. Hier eine Übersicht zu den vier Möglichkeiten, die sich bei der Ringbildung von Glucose ergeben.
| Verschiedene Formen und Darstellungen von D-Glucose im Vergleich | ||
|---|---|---|
| Keilstrichformel | Haworth-Projektion | |
|
 α-D-Glucofuranose |
 β-D-Glucofuranose |
 α-D-Glucopyranose |
 β-D-Glucopyranose | |
Da die Fischer-Projektion hier nicht mehr verwendbar ist, hat sich eine weitere, genau festgelegt Darstellungsart für die Ringe etabliert, die sogenannte Haworth-Projektion oder -Darstellung.
Das Molekül wird als ebenes Sechseck bzw. Fünfeck gezeichnet, obwohl der Ring tatsächlich nicht eben ist (wie es Benzol möglich ist). Mit diesen Anordnungen beschäftigen wir uns später noch einmal kurz, wie schon vorhin erwähnt.
Ein im Ring enthaltenes Sauerstoff-Atom nimmt bei Ringen mit fünf Atomen die Position in jener Ecke ein, die vom Betrachter weg zeigt, sodass das Fünfeck mit der gegenüberliegenden Kante (Bindung) nach vorne weist. In einem Sechsring erhält der Sauerstoff die hintere rechte Ecke. Die Kohlenstoff-Atome folgen in ihrer Nummerierung dem Uhrzeigersinn, allerdings muss dabei dem ersten Kohlenstoff-Atom nicht notwendigerweise die Position 1 zukommen. Substituenten (und gelegentlich auch Wasserstoff-Atome) werden senkrecht ober- oder unterhalb der Ringatome gezeichnet. Substituenten, die in der Fischer-Projektion nach rechts weisen, stehen in der Haworth-Projektion unten (und umgekehrt), was die Einordnung eines Moleküls nach der Fischer-Nomenklatur ermöglicht.
Merke: FLOH – was bei Fischer links ist, ist oben bei Haworth
Hier noch einmal etwas vergrößert, mit Nummerierung bei α-D-Glucopyranose
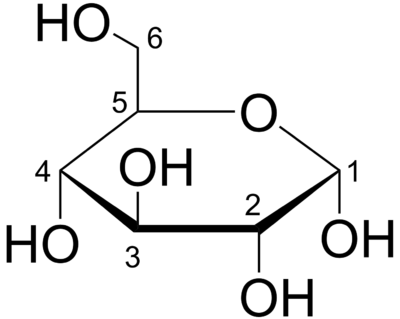
Das Kohlenstoff-Atom 1 ist das "neue" Asymmetrie-Zentrum und aufgrund der Anordnung der OH-Gruppe nach unten, ist es die α-Variante der D-Glucopyranose. Vergleiche mit den vier Varianten der Glucose weiter oben.


![D-(−)-Weinsäure [Synonym: (2S,3S)-Weinsäure]](https://upload.wikimedia.org/wikipedia/commons/thumb/a/ae/D-Weins%C3%A4ure.svg/113px-D-Weins%C3%A4ure.svg.png)
![L-(+)-Weinsäure [Synonym: (2R,3R)-Weinsäure]](https://upload.wikimedia.org/wikipedia/commons/thumb/1/11/L-Weins%C3%A4ure.svg/113px-L-Weins%C3%A4ure.svg.png)