Stereochemie Kohlenhydrate: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 51: | Zeile 51: | ||
# Die Bezeichnungen D- und L- wurden von den lateinischen Wörtern „dexter“ (= rechts) und „laevus“ (= links) abgeleitet. Sie beziehen sich auf die Stellung der funktionellen Gruppe an demjenigen asymmetrisch substituierten Kohlenstoffatom, das am weitesten unten steht. | # Die Bezeichnungen D- und L- wurden von den lateinischen Wörtern „dexter“ (= rechts) und „laevus“ (= links) abgeleitet. Sie beziehen sich auf die Stellung der funktionellen Gruppe an demjenigen asymmetrisch substituierten Kohlenstoffatom, das am weitesten unten steht. | ||
====== Beispiel Glycerinaldehyd: | ====== Beispiel Glycerinaldehyd: ====== | ||
<gallery mode="packed-hover" heights="200"> | |||
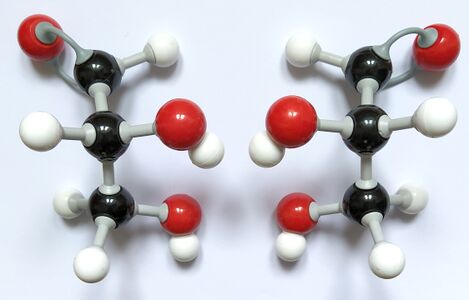
Datei:Glycerinaldehyd Molekülmodelle.jpg|Molekülmodelle von D- und L-Glycerinaldehyd | Datei:Glycerinaldehyd Molekülmodelle.jpg|Molekülmodelle von D- und L-Glycerinaldehyd | ||
Datei:DL-Glycerinaldehyd Fischerprojektion.svg|Fischerprojektion von D- und L-Glycerinaldehyd | Datei:DL-Glycerinaldehyd Fischerprojektion.svg|Fischerprojektion von D- und L-Glycerinaldehyd | ||
Datei:Glycerinaldehyd-Enantiomere Molekülmodelle.jpg|Molekülmodelle von D- und L-Glycerinaldehyd als Bild und Spiegelbild | Datei:Glycerinaldehyd-Enantiomere Molekülmodelle.jpg|Molekülmodelle von D- und L-Glycerinaldehyd als Bild und Spiegelbild | ||
</gallery>Im Foto links liegen die Molekülmodelle so da, wie man die Moleküle in der Fischer-Projektion zeichnet (Aldehyd-Gruppe oben, senkrechte Bindungen zeigen nach hinten, waagerechte nach vorne). Daraus ergeben sich die in der Mitte gezeigten Fischer-Projektionen. Dreht man bei den Modellen das oberste und unterste Kohlenstoffatom um je 180° (Foto rechts), so sieht man, dass sich die Moleküle wie Bild und Spiegelbild verhalten. Es handelt sich also um Spiegelbildisomere (= Enantiomere). | </gallery>Im Foto links liegen die Molekülmodelle so da, wie man die Moleküle in der Fischer-Projektion zeichnet (Aldehyd-Gruppe oben, senkrechte Bindungen zeigen nach hinten, waagerechte nach vorne). Daraus ergeben sich die in der Mitte gezeigten Fischer-Projektionen. Dreht man bei den Modellen das oberste und unterste Kohlenstoffatom um je 180° (Foto rechts), so sieht man, dass sich die Moleküle wie Bild und Spiegelbild verhalten. Es handelt sich also um Spiegelbildisomere (= Enantiomere). | ||
Version vom 22. Oktober 2024, 16:48 Uhr
Glucose ist eine Aldohexose, also ein Zucker mit einer Aldehyd-Gruppe und insgesamt sechs Kohlenstoffatomen, an denen fünf Hydroxy-Gruppen gebunden sind. Da diese Aldohexosen asymmetrisch substituierte Kohlenstoffatome enthalten, tritt eine besondere Form der Isomerie auf, die Stereoisomerie. Das bedeutet, dass die Hydroxy-Gruppen an den vier mittleren Kohlenstoffatomen räumlich unterschiedlich angeordnet sind. Um die verschiedenen Aldohexosen unterscheiden zu können, zeichnet man sie in der Fischer-Projektion.
Exkurs: Isomerie und Chiralität
Isomere sind Moleküle, die dieselbe Summenformel, aber unterschiedliche Strukturformeln haben.
Strukturisomerie
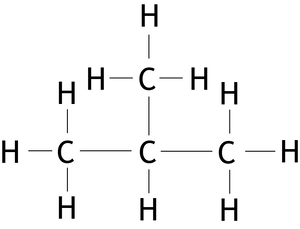
Im Chemieunterricht lernt man das Phänomen der Isomerie normalerweise beim Thema "Alkane" kennen: Das einfachste Alkan, bei dem Isomere vorkommen, ist Butan (): Das eine Isomer (n-Butan) besteht aus einer Kette aus vier Kohlenstoffatomen, beim anderen Isomer hängt eine Methyl-Gruppe an einer Kette aus drei Kohlenstoffatomen (2-Methylpropan). Die beiden Moleküle sind Strukturisomere (Konstitutionsisomere): Um aus dem einen Isomer das andere zu machen, muss man Bindungen trennen und neu knüpfen. Weil die Molekülstrukturen der Isomere unterschiedlich sind, unterscheiden sich auch die Stoffeigenschaften, so hat beispielsweise n-Butan einen etwas höheren Siedpunkt als 2-Methylpropan.
Stereoisomerie
Anders als bei Strukturisomeren sind bei den Stereoisomeren die Atome in derselben Reihenfolge verknüpft, aber der räumliche Aufbau der Moleküle ist unterschiedlich. Bei den Stereoisomeren unterscheidet man verschiedene Varianten, von denen bei den Kohlenhydraten die beiden folgenden vorkommen: Verhalten sich zwei Stereoisomere wie Bild und Spiegelbild zueinander, so nennt man sie Spiegelbildisomere oder Enantiomere (aus dem Griechischen: enantios = entgegengesetzt). Verhalten sie sich nicht so, so nennt man sie Diastereomere.
Bei den Enantiomeren spricht man auch von Chiralität (von griech. cheir = Hand): Chirale Objekte sind zwar gleich aufgebaut, aber mit ihrem Spiegelbild nicht identisch, genau wie unsere Hände. Enantiomere sind also chiral.
Wann sind Moleküle chiral? Falls du einen Molekülbaukasten hast, baue zwei Methanmoleküle (). Stelle sie einander wie Bild und Spiegelbild gegenüber und drehe anschließend eines der Modelle so, dass sie identisch aussehen. Tausche nun bei beiden Modellen eines der Wasserstoffatome gegen ein anderes Atom aus () und wiederhole das Aufstellen und Drehen der Modelle. Tausche nun das nächste Wasserstoffatom gegen ein anderes aus, so dass insgesamt drei verschiedene Atomsorten ( = Substituenten) am zentralen Kohlenstoffatom hängen (). Wiederhole das Aufstellen und Drehen der Modelle. Wiederhole alles mit Molekülmodellen mit vier verschiedenen Substituenten ().
Überlege: Was ist die Voraussetzung dafür, dass es Enantiomere gibt?Falls du keinen Molekülbaukasten hast, kannst du die beschriebene Übung in folgenden Video ansehen und Fragen dazu beantworten.
Halten wir fest: Spiegelbildisomere kann es nur dann geben, wenn es im Molekül mindestens ein Kohlenstoffatom mit vier unterschiedlichen Substituenten gibt. Ein Substituent ist hierbei definiert als alles, was mit einer Einfachbindung an ein Kohlenstoffatom gebunden ist, also Atome wie Wasserstoff oder Chlor, funktionelle Gruppen wie Amino- oder Hydroxy-Gruppen oder größere Molekülteile, z. B. sind bei Glucose die Kohlenstoffatome C1 und C2 mit allem, was daran gebunden ist, ein Substituent von C3. Bei ringförmigen Strukturen ist "Ring in die eine Richtung" ebenso ein Substituent wie "Ring in die andere Richtung".
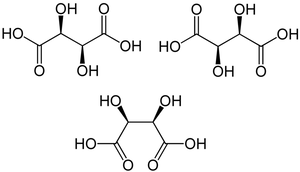
Doch auch wenn in einem Molekül Stereozentren vorhanden sind, muss es nicht in jedem Fall zwei enantiomere Formen geben: Enthält das Molekül eine Drehspiegelachse, ist also auf bestimmte Weise in sich symmetrisch, dann ist es nicht chiral. Ein typisches Beispiel ist die Weinsäure (2,3-Dihydroxybutandisäure): Die Kohlenstoffatome C2 und C3 sind Stereozentren, man würde also vier Stereoisomere erwarten. Tatsächlich gibt es nur drei davon, nämlich die beiden Enantiomere D-Weinsäure und L-Weinsäure, außerdem die meso-Weinsäure, die zu ihnen diastereomer ist.
Die Fischer-Projektion oder "Wie zeichnet man Stereoisomere?"
Vielleicht hast du schon gemerkt, dass es schwierig ist, bei zweidimensionalen Zeichnungen von Strukturformeln den räumlichen Aufbau zu erkennen. Heute verwendet man dafür üblicherweise Formeln, bei denen für die Bindungen statt einfacher Striche Keile verwendet werden, und zwar breiter werdende Keile für Bindungen, die nach vorne zeigen, und gestrichelte Keile für Bindungen, die nach hinten zeigen.
Keile sind allerdings schwieriger zu zeichnen als Striche, vor allem, wenn man noch keine modernen Computerprogramme zur Verfügung hat. Der Chemiker Emil Fischer, die unter anderem die räumliche Struktur der D-Glucose erforscht und aufgeklärt hat, entwickelte daher 1891 die nach ihm benannte Fischer-Projektion. Diese ermöglicht es, dreidimensionale Moleküle so zu zeichnen, dass eindeutig erkennbar ist, welche Substituenten welche räumliche Anordnung haben. Somit kann man natürlich auch leichter erkennen, ob es sich bei zwei Molekülen um Diastereomere oder Enantiomere handelt.
Wie funktioniert die Fischer-Projektion?
Regeln für die Fischer-Projektion:
- Die Kohlenstoffkette wird senkrecht geschrieben. Die Kohlenstoffatome müssen nicht als C hingeschrieben werden, sondern können weggelassen werden.
- Das am höchsten oxidierte Kohlenstoffatom steht (möglichst weit) oben. Die Rangfolge ist: (am höchsten oxidiert) -COOH > -CHO / -CO- > -CH2-OH (am wenigsten oxidiert) Bei Kohlenhydraten steht also die Aldehyd-Gruppe oben bzw. die Keto-Gruppe möglichst weit oben.
- Die senkrechten Bindungen zwischen den Kohlenstoffatomen der Kette zeigen jeweils nach hinten.
- Die waagerechten Bindungen zu den funktionellen Gruppen zeigen jeweils nach vorne.
- Die Bezeichnungen D- und L- wurden von den lateinischen Wörtern „dexter“ (= rechts) und „laevus“ (= links) abgeleitet. Sie beziehen sich auf die Stellung der funktionellen Gruppe an demjenigen asymmetrisch substituierten Kohlenstoffatom, das am weitesten unten steht.
Beispiel Glycerinaldehyd:
Im Foto links liegen die Molekülmodelle so da, wie man die Moleküle in der Fischer-Projektion zeichnet (Aldehyd-Gruppe oben, senkrechte Bindungen zeigen nach hinten, waagerechte nach vorne). Daraus ergeben sich die in der Mitte gezeigten Fischer-Projektionen. Dreht man bei den Modellen das oberste und unterste Kohlenstoffatom um je 180° (Foto rechts), so sieht man, dass sich die Moleküle wie Bild und Spiegelbild verhalten. Es handelt sich also um Spiegelbildisomere (= Enantiomere).