Oberstufen-Chemiebuch Kontextorientiert/Alltags-Kunststoffe - Kohlenstoff-Ketten in viele Variationen: Unterschied zwischen den Versionen
| Zeile 55: | Zeile 55: | ||
* PE-LD hat eine geringe Dichte ('''L'''ow '''D'''ensity) von durchschnittlich etwa 0,925 g/cm<sup>3</sup> | * PE-LD hat eine geringe Dichte ('''L'''ow '''D'''ensity) von durchschnittlich etwa 0,925 g/cm<sup>3</sup> | ||
* PE-LLD hat eine teilweise recht niedrige Dichte von 0,87–0,94 g/cm<sup>3</sup>, der Namen leitet sich von '''L'''inear '''L'''ow '''D'''ensity ab, da trotz der wenig verzweigten Struktur eine niedrige Dichte hat. | * PE-LLD hat eine teilweise recht niedrige Dichte von 0,87–0,94 g/cm<sup>3</sup>, der Namen leitet sich von '''L'''inear '''L'''ow '''D'''ensity ab, da trotz der wenig verzweigten Struktur eine niedrige Dichte hat. | ||
=== Zusammenhang zwischen Struktur und Eigenschaften genauer betrachtet === | |||
Hier hat man einen direkten Zusammenhang zwischen innerer Struktur und der von außen zu messenden Eigenschaft, hier der Dichte. Dichte gibt ja an, wieviel Masse auf ein bestimmtes Volumen kommt. Da wir hier die gleichen Arten an Atomen (''nur C und H'') und eigentlich den gleichen Aufbau haben, geht es letztendlich hier um die Anzahl der Atome, die sich in einem Raumbereich befinden. Und die hängt von dem inneren Aufbau ab. Man kann sich das so vorstellen, dass bei unverzweigten Ketten, wie beim PE-HD, diese Ketten sehr nah aneinander und parallel anlagern können, da nichts absteht. Damit liegen viele Atome näher beieinander und damit ist mehr Masse im gleichen Raumbereich vorhanden. | Hier hat man einen direkten Zusammenhang zwischen innerer Struktur und der von außen zu messenden Eigenschaft, hier der Dichte. Dichte gibt ja an, wieviel Masse auf ein bestimmtes Volumen kommt. Da wir hier die gleichen Arten an Atomen (''nur C und H'') und eigentlich den gleichen Aufbau haben, geht es letztendlich hier um die Anzahl der Atome, die sich in einem Raumbereich befinden. Und die hängt von dem inneren Aufbau ab. Man kann sich das so vorstellen, dass bei unverzweigten Ketten, wie beim PE-HD, diese Ketten sehr nah aneinander und parallel anlagern können, da nichts absteht. Damit liegen viele Atome näher beieinander und damit ist mehr Masse im gleichen Raumbereich vorhanden. | ||
| Zeile 95: | Zeile 97: | ||
Kristalline Bereiche bedeuten ja, dass die Molekülketten parallel liegen und somit wenig Platz einnehmen und damit passen diese Daten gut zu der Dichte der verschiedenen Polyethylen-Typen. | Kristalline Bereiche bedeuten ja, dass die Molekülketten parallel liegen und somit wenig Platz einnehmen und damit passen diese Daten gut zu der Dichte der verschiedenen Polyethylen-Typen. | ||
Liegen die Ketten parallel, so können die Van-der-Waals-Kräfte besser wirken. Die Van-der-Waals-Kräfte sind ja sich zufällig ergebende Dipole, die bei günstiger Lage an Nachbarmoleküle weitergegeben werden können (''temporäre und induzierte Dipole''), wodurch kurzfristig eine Anziehung besteht. Die Anziehung ist umso höher, je größer die Fläche ist und je paralleler die Moleküle liegen. Wenn die Anziehung bei parallelen Ketten größer ist, sollte auch die Siedetemperatur mit höherer Kristallität größer sein. | Liegen die Ketten parallel, so können die Van-der-Waals-Kräfte besser wirken. Die Van-der-Waals-Kräfte sind ja sich zufällig ergebende Dipole, die bei günstiger Lage an Nachbarmoleküle weitergegeben werden können (''temporäre und induzierte Dipole''), wodurch kurzfristig eine Anziehung besteht. Die Anziehung ist umso höher, je größer die Fläche ist und je paralleler die Moleküle liegen. | ||
<gallery widths=350 heights=250> | |||
File:Forze di London.png|Verlagerte Elektronen in der Hülle der Atome. | |||
File:London Forces in alkanes.png|Vergleich gerader und verzweigter Alkane und die Möglichkeit für Van-der-Walls-Kräfte. | |||
</gallery> | |||
Wenn die Anziehung bei parallelen Ketten größer ist, sollte auch die Siedetemperatur mit höherer Kristallität größer sein. Hier nun die Daten: | |||
<center> | <center> | ||
Version vom 17. April 2017, 15:57 Uhr
Nachdem auf der vorherigen Seiet vor allem mit den Prinzipien der Kunststoffchemie beschäftigt haben, soll es nun um konkrete Typen an Kunststoffen gehen mit verschiedenen Monomeren und Polymeren. Dabei werden wir dann die Theorie nutzen, um die Eigenschaften der Stoffe erklären zu können bzw. selber bestimmen können.
Polyethylen
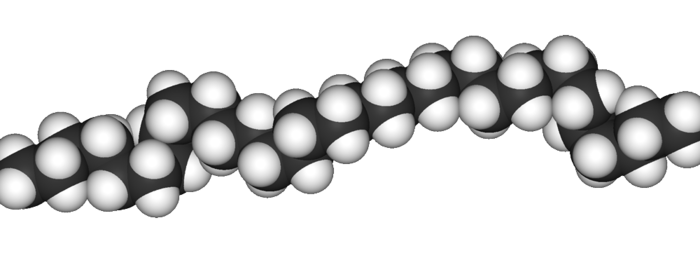
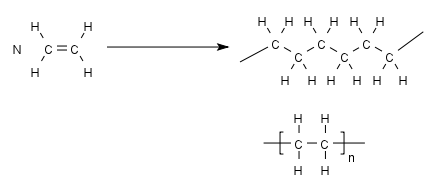
Das Polyethylen (kurz PE) ist zwar nicht das erste Polymer, dass hergestellt wurde, aber es ist das Einfachste. Der Name Polyethylen ergibt sich aus dem Ausgangsstoff, dem Monomer, hier also das Ethylen = Ethen. Es ist deshalb das einfachste, da an der grundlegenden Struktur, die für eine Polymerisationsreaktion notwendig ist, also der Doppelbindung, keine weitere Kette oder Gruppe hängt.
Geschichtliche Entwicklung
Zum ersten Mal wurde 1898 von dem deutschen Chemiker Hans von Pechmann zufällig hergestellt, als er mit Diazomethan (siehe Bild) experimentierte. Man erhielt eine weiße, wachsartige Substanz. Die Entstehung lässt sich recht leicht erklären, denn wenn vom instabilen Diazomethan ein Stickstoff-Molekül abgespalten wird, werden CH2-Gruppen frei, die sich zu einer langen Kette zusammensetzen können. Da Diazomethan sehr instabil ist, deswegen nicht in größeren Mengen gelagert werden kann und nebenbei auch giftig ist, ist die Herstellungsweise wenig erfolgreich gewesen.
Die erste industrielle Polyethylen-Synthese wurde (wieder durch Zufall) 1933 in England von Chemikern entdeckt, die für die ICI (Imperial Chemical Industries) arbeiteten. Bei extrem hohen Drücken (ca. 1400 bar) erzeugten sie aus einem Gemisch aus Ethylen und Benzaldehyd ein weißes, wachsartiges Material. Das Benzaldehyd ist für die Reaktion nicht wirklich von Bedeutung und tatsächlich funktionierte die Methode nur wegen kleinen Mengen an Sauerstoff, die ins Reaktionsgefäß gelangt waren. Zwei Jahre später konnte dann aber wieder ein Chemiker von ICI eine tatsächlich funktionierende und nachvollziehbare Hochdrucksynthese für Polyethylen vorstellen. Sie war die Grundlage für die industrielle Produktion am 1939.
Ein weiterer Meilenstein in der industriellen Herstellung von Polyethylen war die Entwicklung von Katalysatoren, die die Polymerisation bei milden Temperaturen und Drücken ermöglichen. Immer noch verwendet wird der 1953 nach seinen Entdeckern (Karl Ziegler und Giulio Natta) benannte Ziegler-Natta-Katalysator, der Titanhalogeniden und aluminiumorganischen Verbindungen enthält.
Verschiedene Typen von Polyethylen
Rein theoretisch ist eine solche Polymerisation ja eine eindeutige Sache:
- mit einer Startreaktion wird eine Doppelbindung (hier am Ethylen) aufgespalten und damit die Kettenreaktion vorbereitet
- in der Kettenreaktion bindet sich immer wieder eine C2H4-Gruppe nach der anderen, so dass die Kette länger und länger wird.
Natürlich wird nicht nur an einer Stelle gestartet, aber wir gehen zunächst einmal davon aus, dass jede einzlene Kettenverlängerung für sich abläuft. Tatsächlich ist es so, das bei den ersten Polyethylen-Synthesen, aufgrund hohen Temperaturen gar keine so geordnete Polymerisation stattgefunden hat. Stattdessen kann man sagen, das die hohen Temperaturen an ganz vielen Stellen gleichzeitig die Doppelbindungen aufbrechen, dabei Radikale entstehen und so gleichzeitig viele Ketten anfangen zu wachsen. Diese radikalischen Ketten könnten sich dann beliebig mit anderen Ketten verbinden und durch Umlagerungen innerhalb des Ketten-Moleküls kann auch eine Seitenkette an einer längeren angehängt werden. Tatsache ist, dass die ersten Polyethlene sehr stark verzweigte Ketten bildeten, die man sich so vorstellen kann:
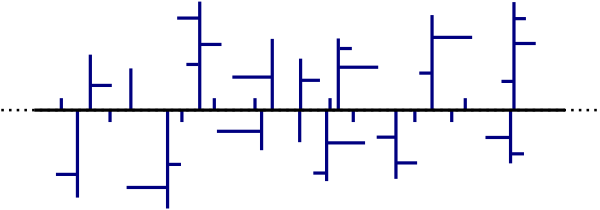
Führt man stattdessen die Polymerisation bei niedrigen Temperaturen durch, wie es zum Beispiel beim Ziegler-Natta-Katalysator der Fall ist, so kann man den Verzweigungsgrad genau bestimmen. Für die Entdeckungen zur Nutzung von Katalysatoren bei der Polymerisation bekamen Karl Ziegler und Giulio Natta 1963 den Nobelpreis für Chemie.
Statt der stark verzweigten Struktur, ist mit dem Katalysator nun möglich auch wenig bis gar nicht verzweigte Polyethylensorten zu gewinnen.
| PE-HD oder HDPE | |
| PE-LLD oder LLDPE | |
| PE-LD oder LDPE | 
|
Die verschiedenen Kürzel, die hinter den Buchstaben PE stehen, beschreiben den wesentlichen Unterschied zwischen den drei Sorten, nämlich die unterschiedliche Dichte:
- PE-HD hat einen hohe Dichte (High Density) von durchschnittlich etwa 0,955 g/cm3
- PE-LD hat eine geringe Dichte (Low Density) von durchschnittlich etwa 0,925 g/cm3
- PE-LLD hat eine teilweise recht niedrige Dichte von 0,87–0,94 g/cm3, der Namen leitet sich von Linear Low Density ab, da trotz der wenig verzweigten Struktur eine niedrige Dichte hat.
Zusammenhang zwischen Struktur und Eigenschaften genauer betrachtet
Hier hat man einen direkten Zusammenhang zwischen innerer Struktur und der von außen zu messenden Eigenschaft, hier der Dichte. Dichte gibt ja an, wieviel Masse auf ein bestimmtes Volumen kommt. Da wir hier die gleichen Arten an Atomen (nur C und H) und eigentlich den gleichen Aufbau haben, geht es letztendlich hier um die Anzahl der Atome, die sich in einem Raumbereich befinden. Und die hängt von dem inneren Aufbau ab. Man kann sich das so vorstellen, dass bei unverzweigten Ketten, wie beim PE-HD, diese Ketten sehr nah aneinander und parallel anlagern können, da nichts absteht. Damit liegen viele Atome näher beieinander und damit ist mehr Masse im gleichen Raumbereich vorhanden.
Beim PE-LD und PE-LLD ist der Abstand offensichtlich größer (also weniger Atome pro Raumbereich), was sich damit erklären lässt, dass die Seitenketten dazu führen, dass die Ketten ungeordnet neben- bzw. durcheinanderliegen.
Die Anzahl und Art der Seitenketten hat noch eine andere Auswirkung. Zum einen eine eher theoretische Bezeichnung, die sich aus der Anordnung der Seitenketten betrifft. Dazu noch einmal kurz als Wiederholung:
Wie sich der unterschiedliche Molekülaufbau auf den Anteil an kristallinen Bereichen auswirkt kannst an der folgenden Tabelle auslesen. Dazu noch einmal die genauen Daten zur Dichte im Vergleich:
| Eigenschaft | PE-LD | PE-HD | PE-LLD |
|---|---|---|---|
| Dichte in g/cm3 | 0,915–0,935 | 0,94–0,97 | 0,87–0,94 |
| Kristallinität in % | 40–50 | 60–80 | 10–50 |
Kristalline Bereiche bedeuten ja, dass die Molekülketten parallel liegen und somit wenig Platz einnehmen und damit passen diese Daten gut zu der Dichte der verschiedenen Polyethylen-Typen.
Liegen die Ketten parallel, so können die Van-der-Waals-Kräfte besser wirken. Die Van-der-Waals-Kräfte sind ja sich zufällig ergebende Dipole, die bei günstiger Lage an Nachbarmoleküle weitergegeben werden können (temporäre und induzierte Dipole), wodurch kurzfristig eine Anziehung besteht. Die Anziehung ist umso höher, je größer die Fläche ist und je paralleler die Moleküle liegen.
Wenn die Anziehung bei parallelen Ketten größer ist, sollte auch die Siedetemperatur mit höherer Kristallität größer sein. Hier nun die Daten:
| Eigenschaft | PE-LD | PE-HD | PE-LLD |
|---|---|---|---|
| Kristallinität in % | 40–50 | 60–80 | 10–50 |
| Schmelzpunkt in °C | 130–145 | 130–145 | 45–125 |
Polypropylen (PP)
Polyvinylchlorid (PVC)
Polystyrol (PS)
, besser bekannt in geschäumtem Zustand als Styropor® (Handelsname der BASF) == Polytetrafluorethylen (PTFE) ==, Handelsname ist Teflon® (E. l. Du Pont de Nemours and Company) oder Tefal® == Polymethylmethacrylat (PMMA) ==, unter dem Handelsnamen Plexiglas® (Evonik Industries AG)
Polyacrylnitril (PAN)
, als Copolymer mit Polymethylmethacrylat zur Herstellung von Textilfasern