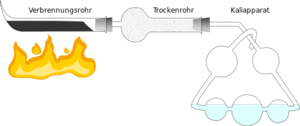Durchführung der Elementaranalyse
Ursprünglich erfunden wurde diese Methode, die generell für die Bestimmung von Elementverhältnissen in organischen Verbindungen geeignet ist, von Antoine de Lavoisier, erheblich verbessert wurde sie später von Justus von Liebig, nach dem sie häufig benannt wird.
Grundsätzlich beruht die Methode darauf, dass man eine genau abgewogene Menge eines organischen Reinstoffs zu Kohlenstoffdioxid und Wasser reagieren lässt. Die Reaktionsprodukte werden aufgefangen, damit man ihre Masse bestimmen kann. Anhand der gemessenen Werte kann man das Verhältnis der Elemente berechnen, aus denen die untersuchte Verbindung besteht.
Für die quantitative Elementaranalyse benötigt man eine reine organische Substanz. Man muss also gegebenenfalls vorher durch verschiedene Reinigungsmethoden wie Destillation oder Chromatographie dafür sorgen, dass keine Verunreinigungen mehr enthalten sind. Von der gereinigten Substanz wiegt man eine ganz bestimmte Menge ein und gibt sie in einem Behälter ins Verbrennungsrohr. Ebenfalls im Verbrennungsrohr befindet sich Kupfer(II)-oxid, das als Oxidationsmittel dient.
Nun erhitzt man das Kupfer(II)-oxid und die organische Substanz, was zu einer Redoxreaktion führt, bei der die Substanz zu Kohlenstoffdioxid und Wasser oxidiert wird und Kupfer(II)-oxid zu Kupfer reduziert wird.
Die entstandenen Gase (Kohlenstoffdioxid und Wasserdampf) werden durch die Apparatur geleitet. Das entstandene Wasser wird im Trockenrohr von Calciumoxid absorbiert. Das Kohlenstoffdioxid löst sich in der Kalilauge, die sich im Kaliapparat befindet. Sowohl vor als auch nach der Analyse bestimmt man die Masse des Trockenrohrs und des Kaliapparats, so dass man an der Gewichtszunahme sehen kann, wie viel Wasser und wie viel Kohlenstoffdioxid bei der Reaktion entstanden sind.
Jetzt beginnt die Rechnerei, die wir an folgendem Beispiel durchgehen wollen.
Beispielrechnung: Elementaranalyse von Trinkalkohol
Man wiegt 0,521 g Alkohol ein. Die Massenzunahme des Trockenrohrs beträgt 0,620 g, die des Kaliapparats 0,987 g. Das bedeutet, dass bei der Verbrennung 0,620 g Wasser (H2O) und 0,987 g Kohlenstoffdioxid (CO2) entstanden sind. Mit diesen Werten kann man den Wasserstoffanteil und den Kohlenstoffanteil folgendermaßen berechnen:
Kohlenstoffanteil: 1 mol CO2 wiegt 44 g, davon sind 12 Kohlenstoff, also 44 g/12 g x 100 = 27,3 %. Bei unserem Experiment sind 0,987 g Kohlenstoffdioxid entstanden.
27,3 % davon sind Kohlenstoff, also 0,987 g x 27,3 % = 0,269 g
Wasserstoffanteil: 1 mol H2O wiegt 18 g, davon sind 2 g Wasserstoff (2 x H). Das entspricht 11,1 %. Aus 0,521 g Alkohol sind 0,620 g Wasser entstanden.
Davon sind 11,1 % Wasserstoff, also 0,620 g x 11,1 % = 0,069 g
Sauerstoffanteil: Diesen letzten Anteil berechnet man, indem man einfach von der Probenmasse, die man verbrannt hat, den Kohlenstoffanteil und den Wasserstoffanteil abzieht. Übrig bleibt der Sauerstoffanteil:
mAlkohol – mWasserstoff – mKohlenstoff = 0,521 g – 0,069 g – 0,269 g = 0,183 g
→ Massenverhältnis von Kohlenstoff : Wasserstoff : Sauerstoff = 0,269 g : 0,069 g : 0,183 g
Berechnung des Stoffmengenverhältnisses
Um auf die Verhältnisformel zu kommen, muss man das Stoffmengenverhältnis berechnen. Das bedeutet, dass man ausrechnet, wie viel mol Kohlenstoff, Wasserstoff und Sauerstoff in der Probe enthalten sind. Dafür teilen wir die errechneten Massen jeweils durch die molare Masse des Stoffes. Kohlenstoff: 0,269 g / 12 g·mol-1 = 0,022 mol Wasserstoff: 0,069 g / 1 g·mol-1 = 0,069 mol Sauerstoff: 0,183 g / 16 g·mol-1 = 0,011 mol
→ Stoffmengenverhältnis C : H : O = 0,022 mol : 0,069 mol : 0,011 mol
So, wir haben es fast geschafft. Um eine Verhältnisformel aufzustellen, braucht man ganze Zahlen. Um diese zu berechnen, teilt man alle Stoffmengen durch die kleinste Stoffmenge (hier n(O), die Stoffmenge von Sauerstoff). Aufgrund von Messfehlern und Ungenauigkeiten beim Runden erhält man dabei normalerweise keine ganzen Zahlen. Daher rundet man anschließend auf ganze Zahlen auf oder ab.
In unserem Fall ergibt sich zunächst C : H : O = 2 : 6,3 : 1,
gerundet: C : H : O = 2 : 6 : 1
Dieses Stoffmengenverhältnis besagt, dass in Alkohol auf je 2 Kohlenstoffatome 6 Wasserstoffatome und 1 Sauerstoffatom kommen. Man kann daraus eine chemische Verhältnisformel aufstellen: (C2H6O)n